臍帯由来MSCの免疫抑制能を利用
日本医療研究開発機構(AMED)は7月17日、東京大学医科学研究所附属病院セルプロセッシング・輸血部の長村登紀子准教授らの研究グループが治療抵抗性重症急性移植片対宿主病に対する臍帯由来間葉系細胞(IMSUT-CORD)輸注療法の医師主導治験を開始すると発表した。
画像はリリースより
造血幹細胞移植後の重症急性移植片対宿主病(GVHD)は、造血幹細胞移植ドナーのリンパ球が患者組織抗原に反応して増殖し、患者臓器を攻撃する過剰な免疫反応であり、移植後の予後を左右する重要な因子である。
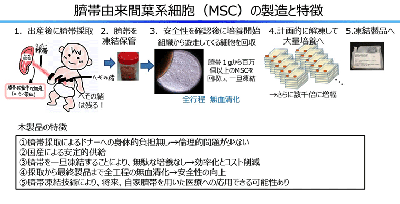
同研究グループは、臍帯から豊富な間葉系細胞(MSC)が採取できることを国内で初めて報告。臍帯由来MSCがもつ免疫抑制能を利用してGVHDを治療する再生医療等製品として製品化(製品名:IMSUT-CORD)に取り組んできた。
東大医科研病院・都立駒込病院・虎の門病院の3施設で実施
今回研究グループは、医薬品医療機器総合機構(PMDA)への治験届を経て、重症急性GVHDの患者を対象に、同治療の安全性を検討する第1相臨床試験を実施。この治験は、AMED再生医療実用化研究事業「同種臍帯由来間葉系細胞を用いた重症急性移植片対宿主病に対する医師主導治験を目指した研究」(研究開発代表者:長村登紀子)の研究支援を受け、東大医科研病院で製造し、東大医科研病院、都立駒込病院および虎の門病院の3施設で実施する。
IMSUT-CORDはMSCの基本特性である免疫抑制能と組織修復能を有することに加え、ドナーへの身体的負担なく採取できること、国内ドナー由来臍帯としてトレーサビリティが高いこと、低抗原性であること、製造工程に牛胎仔血清が含まれておらず感染のリスクが低いこと、増殖能が高いこと等の利点があり、同種細胞の製品として汎用性が高い。この治験により、日本初の国産臍帯由来再生医療等製品の実用化に向けて、大きく前進することが期待される。
また、同治験において安全性の確認とPOC(Proof of Concept)確立後は、ヒューマンライフコード株式会社による企業治験を進める予定。同製品は、新生児脳症などの他の疾患についても非臨床POCを得ており、同治験による安全性・POC獲得後、他疾患への応用を速やかに目指すことができるという。
なお、東大医科研病院は、2017年度より院内の臨床研究支援組織のひとつとして「東大医科研臍帯血・臍帯バンク」を設置し、研究用検体を含め、企業にも試料を提供する仕組みを構築。海外ではすでに臍帯由来MSCの造血幹細胞移植の生着促進とGVHD予防、血液疾患、神経疾患(脳性麻痺や脳挫傷、変性疾患)、糖尿病、心筋梗塞、肝硬変、膠原病など、多様な疾患に対する臨床試験が開始されている。臍帯はドナーへの身体的危険がなく採取可能で、増殖力の高い理想的なMSCソースとして、さらなる適応拡大が期待される。
▼関連リンク
・日本医療研究開発機構(AMED) プレスリリース






