がん細胞の自滅を引き起こす活性酸素が関与
北海道大学は7月13日、がん細胞の浸潤性と放射線抵抗性に共通して関与する新たな分子メカニズムを明らかにしたと発表した。この研究は、同大大学院医学研究院の佐邊壽孝教授、小野寺康仁講師らの研究グループと、白博樹教授が総括する同大国際連携研究教育局(GI-CoRE)量子医理工学グローバルステーションのスタンフォード大学ユニットとの連携により行われた。研究成果は「Nature Communications」に掲載されている。
画像はリリースより
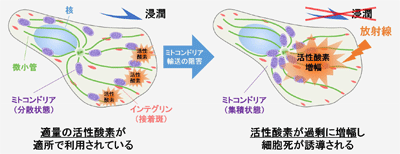
多くのがん細胞では内部で活性酸素が増え、浸潤性を含め、人体へさまざまな悪影響(悪性形質)が生じる。一方で、過剰な活性酸素はがん細胞にとっても有害であり、自らの細胞死を引き起こすことが知られている。このような背景から、がん細胞が活性酸素という「諸刃の剣」を巧みに使いこなすメカニズムを解明することで、悪性形質を抑えこみつつ、がん細胞を自滅させることができると考えられていた。
Arf6-AMAP1-PRKD2経路を阻害すると、活性酸素が増幅
ミトコンドリアは細胞内の活性酸素の大部分を作り出す細胞内小器官。その細胞内分布や活性酸素を作る能力ががん細胞のさまざまな悪性形質に関与することが示唆されている。そこで研究グループは、がん細胞の浸潤活性を制御する分子メカニズムとミトコンドリアの分布および活性酸素制御との関わりに着目して解析を行った。
その結果、がん浸潤に深く関与するインテグリンや、その制御に関わるArf6-AMAP1-PRKD2経路を阻害すると、ミトコンドリアの細胞内分布が阻害され、活性酸素が増幅することが判明。また、この現象を利用して活性酸素を局所的に発生させることで、がん細胞を攻撃する放射線照射からの影響の受けやすさを著しく高められることを明らかにしたという。
今回の研究で明らかとなったがん浸潤と連携する分子経路は、悪性度の高いがん細胞に特異的なメカニズムであると考えられるため、これを標的とすることで、がん特異的な放射線増感法の開発が期待される。また、放射線照射のみならず、さまざまな抗がん剤によっても、がん細胞内に活性酸素が生じることが知られていることから、抗がん剤への増感にも応用できる可能性がある、と研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース




