神経変性疾患などの要因となるマイトファジーの機能破綻
新潟大学は6月20日、タンパク質脱リン酸化酵素Ppg1が、ミトコンドリアオートファジー(マイトファジー)を抑制する制御因子として機能していることを発見したと発表した。この研究は、同大大学院医歯学総合研究科機能制御学分野の古川健太郎特任助教、神吉智丈教授らの研究グループと、東京工業大学生命理工学院の中戸川仁准教授らとの共同研究によるもの。研究成果は、「Cell Reports」に掲載された。
ミトコンドリアは、細胞が必要とするエネルギーの大半を産生する細胞内小器官で、生命活動を行う上で非常に重要な役割を果たしている。エネルギー産生の過程で傷ついたミトコンドリアは、細胞にとって有害であり、ミトコンドリアのみを標的とするマイトファジーによって除去される必要がある。マイトファジーは、傷害を受けた、あるいは余剰に存在するミトコンドリアを分解することで、ミトコンドリアの恒常性を維持する細胞品質管理機構である。
このマイトファジーの機能が破綻し、細胞内に不良ミトコンドリアが蓄積すると、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)などの神経変性疾患や、老化現象などの要因になると考えられている。マイトファジーは、ミトコンドリア関連疾患治療の糸口として注目されており、酵母からヒトまで多岐に渡るマイトファジーの分子機構と生理的意義の全容解明は急務となっている。
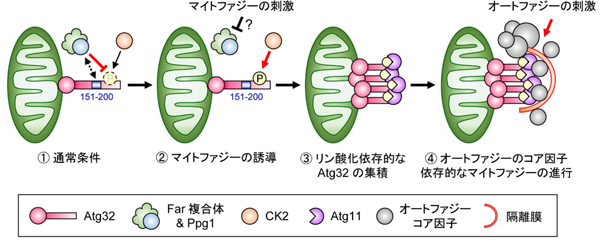
研究グループは先行研究によって、酵母をマイトファジーのモデル生物として用いて、マイトファジーのレセプターとして機能するAtg32の同定など、マイトファジーの分子機構の大部分を明らかにしてきた。Atg32がカゼインキナーゼ2(CK2)という酵素によってリン酸化されることがマイトファジーの引き金となることがわかったが、CK2は常に活性を持った状態で細胞内に大量に存在するにもかかわらず、Atg32のリン酸化はマイトファジー誘導時のみ起こる現象であることから、通常条件下ではどのようにリン酸化が抑制されているのかはわかっていなかった。
マイトファジーの新たな制御機構モデルを提唱
研究グループは、Atg32のリン酸化を抑制する因子を探索する方法として、マイトファジーが誘導されると、Atg32がリン酸化依存的にミトコンドリア上にドット状に集積する現象に着目。マイトファジーを誘導せずにこのような特徴を示す変異株を探索し、脱リン酸化酵素Ppg1を同定したという。Ppg1を欠損させると、CK2依存的にAtg32の恒常的なリン酸化が起こり、その結果としてマイトファジーの亢進が見られた。Atg32のリン酸化だけでは、マイトファジーは進行せず、オートファジーのコアとなる部分も同時に活性化されることが重要だと判明したという。
画像はリリースより
また、マイトファジー以外のオートファジー、例えばペルオキシソームという細胞内小器官を分解するペキソファジーやそのレセプターであるAtg36の制御にはPpg1は関与しないことも明らかになったという。
次に、Ppg1と結合する因子をプロテオーム解析で探索したところ、Far複合体(Far3、7、8、9、10、11の6タンパク質から成る)が同定された。Far複合体を欠損させると、Ppg1欠損と同様にAtg32の恒常的なリン酸化とマイトファジーの亢進が見られたという。
最後に、マイトファジーの抑制にAtg32タンパク質のどの領域が重要なのかを調査。Atg32のアミノ酸配列151-200番目の領域を欠損させると、Ppg1欠損とほぼ同様の結果となったことから、Ppg1はこの領域を介してAtg32を脱リン酸化していると推測されたとしている。
今回の研究により、タンパク質リン酸化酵素と脱リン酸化酵素の競合によるマイトファジーの新たな制御機構モデルが提唱された。マイトファジーの誘導条件下において、Ppg1とFar複合体は未解明のシグナルによって不活性化され、Atg32を脱リン酸化することができなくなり、結果的にAtg32はCK2によるリン酸化を受けると推測されるという。今後は、このシグナルの正体と詳細な分子機構を明らかにすることでマイトファジーの制御機構の全容解明を目指す、と研究グループは述べている。
▼関連リンク
・新潟大学 プレスリリース



