ALSの根治治療に繋がる可能性がある異常凝集体の除去
京都大学は、筋萎縮性側索硬化症(ALS)の原因タンパク質であるTDP-43の異常凝集体を除去する治療抗体の開発に成功したと発表した。この研究は、滋賀医科大学内科学講座神経内科の漆谷真教授、玉木良高特別研究学生(現病院助教)らの研究グループと、京大大学院医学研究科神経内科の高橋良輔教授、慶應義塾大学理工学部の古川良明准教授との共同研究によるもの。研究成果は、英科学誌「Scientific Reports」でオンライン公開された。
画像はリリースより
ALSは全身の筋肉が萎縮し力が入らなくなくなる重篤な神経難病で、進行とともに全身の運動ニューロンが消失する。進行を遅らせる治療の開発は徐々に進んでいるものの、根治的な治療法はまだ見つかっていない。原因は長らく不明だったが、本来細胞の核内に存在するRNA結合タンパク質TDP-43が、ALS患者の運動ニューロンの核から消失し、細胞質で異常な凝集体を形成していること、さらにこの凝集体によって、神経細胞死に至るさまざまな有害事象が起こることが判明し、TDP-43の異常な凝集体を除去することがALSの根治治療に直結するという可能性が注目されていた。
抗体蓄積による有害事象の懸念も少なく
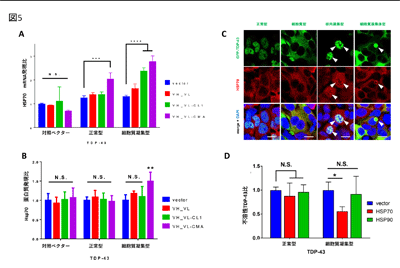
滋賀医科大学は2012年に、異常構造をとったTDP-43のみを認識し正常な核内のTDP-43には結合しない、モノクローナル抗体3B12Aを開発していた。今回の研究では、この抗体を細胞内の異常タンパク質を除去する遺伝子治療薬とするため、3B12A抗体分子の中で抗原と結合する重鎖、軽鎖由来の可変領域遺伝子をクローニングし、2つを繋いで一本鎖抗体(scFv)を作り出す人工遺伝子を作製。さらに凝集体をオートファジーで効率よく分解するため、シャペロン介在性オートファジー(CMA)シグナルというタンパク質分解シグナル遺伝子をscFvに付与し、自己分解型細胞内抗体を発現するベクター遺伝子(3B12A scFv-CMA)を作製した。
その結果、自己分解型細胞内抗体は培養細胞で異常なTDP-43のみと結合し、凝集体を減少させ、さらに凝集体によって生じる細胞死を著明に抑制したことがわかった。興味深いことに、3B12A scFv-CMAと異常凝集体との結合によって分子シャペロンheat shock protein70(HSP70)が誘導され、TDP-43の異常凝集体を解きほぐすことで減少させる(リフォールド)効果も認められた。3B12A scFv-CMAの凝集体減少効果は培養細胞のみならず、子宮内電気穿孔法を用いて遺伝子を導入した胎児マウス脳においても、TDP-43凝集体の著明な抑制効果を認め、脳の発育に明らかな有害事象を認めなかったという。
この自己分解型細胞内抗体は、結合する凝集体が存在しない細胞では速やかに分解されるため、抗体蓄積による有害事象の懸念も少なく、分子標的治療として極めて有望と考えられる。ALSにおける運動ニューロンへのTDP-43異常凝集体を再現するALSモデルマウスでの効果確認や、サルなどの霊長類での安全性確認実験が必要。研究グループは、「オートファジーとプロテアソームという2つの分解系での自己分解能を付与した抗体を使って細胞内の凝集体を除去するというユニークなアプローチで、難病ALSの根治治療の道を開く成果だ」と述べている。
▼関連リンク
・京都大学 トピックス



