アポトーシス誘導ペプチドをEGFR陽性がん細胞へ送達
東京医科歯科大学は5月29日、上皮成長因子受容体(EGFR)の二量体化アーム構造を基に設計した環状ペプチドを細胞内送達分子として利用し、アポトーシス誘導ペプチドをEGFR陽性がん細胞へ送達することに成功したと発表した。この研究は、同大生体材料工学研究所メディシナルケミストリー分野の玉村啓和教授の研究グループによるもの。研究成果は、米化学会誌「Bioconjugate Chemistry」オンライン版で発表された。
画像はリリースより
EGFRは、チロシンキナーゼ型の膜タンパク質であり、多くのがん細胞で過剰に発現している。細胞表面に存在するEGFRは、抗体(Cetuximab)やペプチド性リガンドなどが細胞外領域に結合した場合に、非活性型の状態で細胞内に内在化することが知られている。このような受容体介在性エンドサイトーシスは、がん細胞に対して薬剤を効率的に送達する手法へと利用できる。
EGFRを標的としたいくつかのペプチド性リガンドが報告されているが、これらは直鎖状ペプチドであるため、プロテアーゼによる消化・分解を受けやすく、さらに軽微なEGF様の作用が見られるため薬物送達分子としての使用には限界がある。このような欠点を克服できれば、EGFR陽性がん細胞を標的としたがん治療に応用できる優れた薬物送達分子を創出できると考えられる。
選択性の高いがんの新規治療法開発への応用に期待
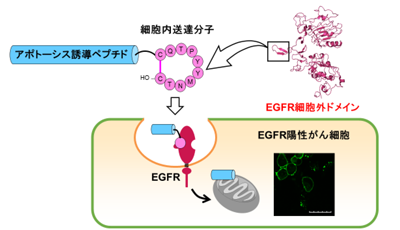
研究グループは、EGFRの細胞外領域に存在する「二量体化アーム」と呼ばれるループ構造に着目。この構造をミミックする新規環状デカペプチドCQTPYYMNTC(1)を設計、合成し、キナーゼ活性阻害活性を有することを見出している。このペプチド1についてEGFR陽性がん細胞に対する細胞内薬物送達分子としての機能を評価し、それを利用したより効果的なアポトーシス誘導分子の創出を検討した。
siRNAによるEGFRのノックダウンの実験で、EGFRの発現レベルとペプチド1の細胞内取り込み量の間に正の相関が見られたことから、ペプチド1のEGFRに対する選択性を確認。単独では細胞膜不透過性であるが、細胞内に導入された場合に細胞のアポトーシスを誘導するペプチド(proapoptotic domain peptide; PAD,[KLAKLAK]2)をペプチド1のN末端にペプチド性リンカーを介して連結させたコンジュゲートペプチド2を設計した。リンカー部位は、がん細胞において高発現しているリソソーム内酵素カテプシンBによって認識・切断される4残基のアミノ酸配列(GFLG)を用いた。EGFR陽性がん細胞A549を用いて、細胞の生存率を評価した結果、ペプチド2を処理した場合では、濃度依存的に細胞の生存率が減少。しかし、PADペプチドのみでは、細胞に対する影響は見られなかったという。すなわち、リソソーム内において切断されるアミノ酸配列をリンカーとして用いたことで、細胞内に導入されたペプチド2がペプチド1とPADに分割され、細胞質中に放出されたPADがアポトーシスを誘導した。
以上の結果より、環状ペプチド1は、がん細胞に存在するEGFRを標的とした「細胞内薬物送達分子」として機能し、これを利用したコンジュゲートペプチド2は、がん細胞選択的なアポトーシス誘導分子に応用できることが判明したとしている。
この研究成果は、EGFR陽性がん細胞を標的としたがんの治療に貢献できると考えられるという。他の抗がん剤をがん細胞へ送達することができれば、その抗がん剤の副作用軽減が可能になり、選択性の高いがんの新規治療法開発への応用が期待できる、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレス通知資料




