近傍遺伝子の発現へ影響するERVの異常発現
京都大学は5月17日、哺乳動物の体細胞で内在性レトロウイルス(ERV)の発現を抑制する普遍的な仕組みを明らかにしたと発表した。この研究は、理化学研究所眞貝細胞記憶研究室の加藤雅紀協力研究員(現・生命医科学研究センター上級研究員)、開拓研究本部眞貝細胞記憶研究室の眞貝洋一主任研究員と京都大学ウイルス・再生医科学研究所の竹本経緯子助教らの共同研究グループによるもの。研究成果は、国際科学雑誌「Nature Communications」に掲載された。
画像はリリースより
哺乳動物のゲノム中、ERV由来の配列は約10%存在する。ERVの異常な発現は、近傍遺伝子の発現への影響や、ERV由来RNAに対する免疫応答反応を引き起こす。体細胞におけるERVの抑制には、DNAのメチル化が重要な役割を果たしている。
H3K9me3修飾がERV抑制に普遍的な役割を持つ可能性
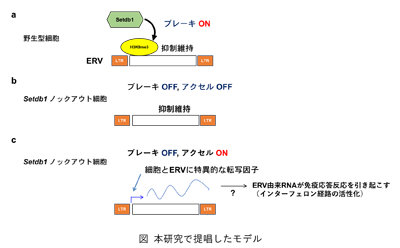
今回、研究グループは、ヒストンH3の9番目のリジンのトリメチル化(H3K9me3)修飾を担うヒストンメチル化酵素Setdb1遺伝子をさまざまな種類のマウス体細胞でノックアウトし、ERVの脱抑制を網羅的に検証した。その結果、Setdb1ノックアウト体細胞ではERV領域のH3K9me3修飾が一様に低下するが、それぞれの細胞に特徴的なERVの種類が脱抑制することが判明。また、DNAのメチル化はERVの抑制には限定的であること、組織特異的な転写因子がERVの発現に重要であることが明らかになったという。
これまで、DNAのメチル化が体細胞では一般的にERVの発現抑制に重要だと考えられていたが、今回の研究結果より、ヒストンH3K9me3修飾がERVの抑制に普遍的な役割を持つ可能性が明らかになったとしている。
ERVの異常な発現は自己免疫疾患を引き起こすことが示されており、ERVの抑制機構についての研究は、将来的には自己免疫疾患の発症メカニズムの解明につながることが期待できる、と研究グループは述べている。
▼関連リンク
・京都大学 研究成果




