新たな治療法の開発には骨吸収メカニズムの解明が必要
岩手医科大学は5月1日、骨を分解する酵素がリソソームから分泌されるメカニズムを明らかにしたと発表した。この研究は、同大薬学部の後藤(松元)奈緒美助教、關谷瑞樹助教、二井將光名誉教授、中西(松井)真弓教授、同大医歯薬総合研究所の遠山稿二郎前教授、石山(松浦)絵里技術員、同志社女子大学薬学部の孫(和田)戈虹教授、大阪大学産業科学研究所の和田洋准教授らの研究グループによるもの。研究成果は、「Scientific Reports」に掲載されている。
画像はリリースより
高齢化により患者が増加している骨粗しょう症は、骨吸収の過度な亢進が原因だ。治療薬はあるが、重篤な副作用が知られている。一方、骨吸収ができなくても大理石病という骨折や感染症の起こりやすい病気を発症するが、有効な治療法は見つかっていない。
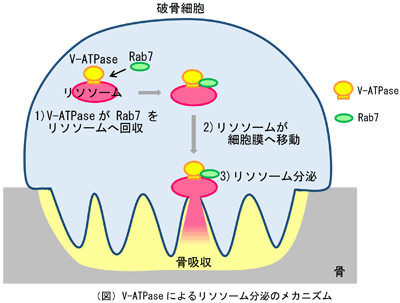
骨吸収をコントロールする新たな治療法の開発のためには、骨吸収のメカニズムの解明が必要だ。破骨細胞が骨吸収する際には、リソソームと呼ばれる細胞小器官が細胞膜へ向かって移動し、細胞膜と融合。これは「分泌リソソーム」と呼ばれ、この仕組みによってリソソームの酵素が細胞外へ分泌され、骨を分解する。分泌リソソームは、破骨細胞だけでなく、免疫細胞や色素細胞、がん細胞においても重要な現象であるものの、リソソームが細胞膜へ向かって移動するメカニズムの詳細はわかっていなかった。
免疫疾患やがんの治療への応用も期待
研究グループは、タンパク質「液胞型ATPase(V-ATPase)」がリソソームの分泌に必須であることを発見。このV-ATPaseは、膜を介してプロトン(水素イオン)を運ぶことにより、酸性環境を形成するプロトンポンプとして働くという。
通常、マウスの破骨細胞では、分泌リソソームは細胞膜へ向かって移動するが、 V-ATPaseの遺伝子を欠損したマウスでは、移動が見られなかったという。また、リソソームの移動を開始するスイッチとして働くタンパク質「Rab7」は、V-ATPaseがないとリソソームに局在できなくなり、V-ATPaseはRab7と結合することも発見した。これらのことから、リソソームに存在するV-ATPaseは、Rab7と結合することでRab7をリソソームに回収し、リソソームの移動を開始することが明らかになったとしている。
これらの研究成果は、骨粗しょう症や大理石病など骨代謝疾患の発症メカニズムの解明や治療法の開発に役立つと考えられる。さらに、分泌リソソームは、免疫細胞による不要細胞の除去や、がん細胞の転移にも関わることから、研究グループは「免疫疾患やがんの理解と治療への応用も期待される」と述べている。
▼関連リンク
・岩手医科大学 プレスリリース



