従来の皮膚再生治療には感染に弱いなどの問題点が
京都大学は4月17日、同大発の新たな人工皮膚が、新規医療機器として製造承認されたと発表した。この研究は、同大の鈴木茂彦名誉教授、同大医学部附属病院の坂本道治特定講師、同大医学部の森本尚樹非常勤講師(関西医科大学准教授)らの研究グループによるもの。
画像はリリースより
京都大学大学院医学研究科形成外科では、鈴木名誉教授らによって開発された、コラーゲンスポンジをシリコーンフィルムで覆った二層構造をもつ人工皮膚、いわゆる二層性人工真皮を用いた皮膚再生治療を行ってきた。この人工皮膚は、皮膚が欠損した創面に貼付すると、皮膚再生に必要な細胞や毛細血管がコラーゲンスポンジ内に入り込み、患者自身の擬似真皮が新生され、スポンジ自体は吸収されてなくなる。
しかし、この人工皮膚治療の問題点として、感染に弱く、血行が不良な創面ではうまく皮膚が再生されないということがあった。このため、近年増加している糖尿病性潰瘍や褥瘡などの難治性皮膚潰瘍に対しては、人工皮膚治療の効果が十分に得られなかったという。また、患者の細胞を培養して人工皮膚に含ませる細胞治療は、皮膚再生が促進される一方、治療費が高額で、一般的な治療として実施する際のハードルとなっていた。
京大病院で医師主導治験、グンゼが承認申請
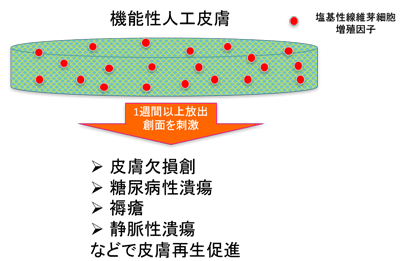
研究グループは、2001年に承認された世界初の皮膚潰瘍治療薬である塩基性線維芽細胞増殖因子(フィブラストスプレー(R)、科研製薬)を人工皮膚に吸着させ、1週間以上かけて徐放する機能性人工皮膚を2005年頃に考案し、基礎研究を行ってきた。その結果、フィブラストスプレー通常投与量の1週間分から2週間分を新規機能性人工皮膚に含ませると、増殖因子の効果がおおよそ10日間程度持続すること、従来の人工皮膚では潰瘍からの血流再開に時間がかかり感染することがあったが機能性人工皮膚では従来の人工皮膚と比較して1/2から1/3の期間で擬似真皮が形成されることを非臨床研究で確認したという。
その後、同大病院で医師主導治験を計画。人工皮膚の製造をグンゼ株式会社が行い、その治験準備を同大病院臨床研究総合センター(iACT)が支援した。その結果、2010年から2011年にかけて医師主導治験が終了。その後、同社が医薬品医療機器総合機構(PMDA)に医療機器としての申請を行い、今回、承認を取得した。承認を受けた使用目的または効果は、熱傷Ⅲ度、外傷性皮膚欠損、腫瘍・母斑切除後の皮膚欠損、皮弁採取部などにより生じた全層皮膚欠損創における肉芽の形成。
細胞成長因子を吸着し徐放することが確認された人工皮膚は同製品が世界初。細胞を含む製品は海外にもあるが、それらに比べるとコストは1/10程度に抑えられるという。また、細胞製品のような輸送・保管時の厳重な温度管理、使用期限の短さなどの問題もない。研究グループは、「今回使用した塩基性線維芽細胞増殖因子以外の成長因子も吸着することが可能であることも確認しており、皮膚再生分野以外の再生医療にも応用可能と考えている」と、今後の展望を述べている。
▼関連リンク
・京都大学 研究成果



