脂肪細胞で最も遺伝子発現量が高いケモカインのSDF-1
大阪大学は4月9日、脂肪細胞が分泌するSDF-1(Stromal derived factor-1)が脂肪細胞のインスリンの効きを悪くし、インスリン誘導性の糖取り込みを低下させることを発見したと発表した。この研究は、同大大学院医学系研究科の福原淳範寄附講座准教授(肥満脂肪病態学)らの研究グループによるもの。研究成果は、米科学誌「Diabetes」に公開された。
画像はリリースより
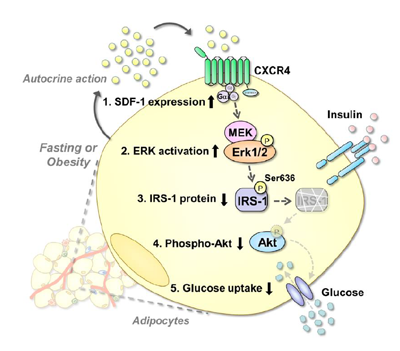
飢餓状態と肥満状態では、インスリンが作用しにくくなることが知られている。副腎皮質ホルモンや炎症性サイトカインなどの脂肪細胞由来ではない外来性の因子が増加し、脂肪細胞に作用することで、インスリン感受性が低下する。
研究グループは、先行研究で脂肪細胞が分泌するアディポサイトカインが、肥満病態の形成に重要な役割を果たすことを報告している。しかし、アディポサイトカインが脂肪細胞自体に作用してインスリン感受性を制御することは知られていなかった。また、アディポサイトカインのひとであるSDF-1は、脂肪細胞では最も遺伝子発現量が高いケモカインだが、細胞への糖取り込みに対する作用は解析されていなかった。
SDF-1KOマウス、血中インスリン濃度が有意に低く
今回、研究グループは、公開されているマイクロアレイデータセットを用いて、脂肪細胞において飢餓状態と肥満状態で発現が上昇する因子としてSDF-1を同定。SDF-1の機能を知るために、マウスの脂肪細胞にSDF-1タンパク質を添加した。その結果、IRS-1タンパク量が減少し、インスリン誘導性のAktタンパク質のリン酸化が減弱し、インスリン誘導性の糖取り込みが低下。そのメカニズムとして、SDF-1がERKリン酸化を誘導し、IRS-1のセリン636リン酸化とタンパク分解を引き起こすことで、IRS-1タンパク量を減少させることを見出したという。
次に、培養脂肪細胞のSDF-1をsiRNAでノックダウンしたところ、IRS-1タンパクが増加し、インスリン誘導性のAktリン酸化が増加、インスリン誘導性の糖取り込みが増加したという。また、SDF-1受容体であるCXCR4の阻害ペプチドTC14012をマウス初代培養脂肪細胞に添加するとIRS-1タンパク質が増加した。これらの結果から、脂肪細胞の内因性SDF-1が脂肪細胞のインスリン感受性を制御することが示されたとしている。
最後に、脂肪細胞特異的SDF-1KOマウスを作成して表現型を調べた結果、同KOマウスはコントロールマウスと比較して、体重や組織重量、摂食量に差がなかったという。空腹時血糖値は差がみられなかったが、血中インスリン濃度は有意に低く、インスリン負荷試験やグルコース負荷試験の血糖値が有意に低下していたという。高脂肪食負荷による肥満状態でも同様だった。同KOマウスはインスリン感受性が増強しており、脂肪組織ではIRS-1タンパク量が増加、インスリン投与後のAktリン酸化が増強していたとしている。
今回の研究成果により、SDF-1シグナルの阻害で脂肪細胞のインスリン感受性を増強させ、肥満2型糖尿病の治療につながることが期待される、と研究グループは述べている。
▼関連リンク
・大阪大学 研究情報



