チャージバリアの正体と考えられていたヘパラン硫酸
東北大学は3月13日、ヘパラン硫酸の合成に必要な遺伝子Extl3の欠損マウスを作成し、腎臓の「ろ過バリア」におけるヘパラン硫酸の意義を明らかにしたと発表した。この研究は、同大大学院医学系研究科分子内分泌学分野の菅原明教授らの研究グループが、同腎・高血圧・内分泌科の青木聡博士、伊藤貞嘉教授、同臨床薬学分野の佐藤博教授らとともに行ったもの。研究成果は「Nephrology Dialysis Transplantation」に掲載されている。
画像はリリースより
慢性腎臓病は、日本の成人8人に1人が患っており、新たな国民病として注目されている。尿タンパクの増加は腎臓病の指標のひとつであり、尿タンパクが多いほど腎機能低下のリスクが上昇することがわかっている。
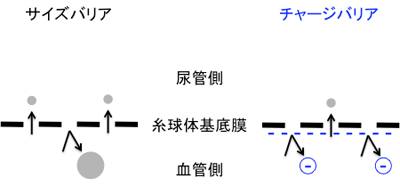
腎臓には血液中の必要な細胞やタンパク質などは排出しないための仕組み「ろ過バリア」があるが、多くの腎臓病では、糸球体のろ過バリアが破綻し、尿中にタンパク質が漏れる。このろ過バリアには、物質を大きさの違いで分けるふるいであるサイズバリアと、電気的なふるいであるチャージバリアの2種類があり、ヘパラン硫酸プロテオグリカン(HSPG)という陰性に帯電した糖タンパク質が、チャージバリアの正体と考えられてきた。
遺伝子欠損マウスでも尿タンパクの増加は認められず
研究グループは、ヘパラン硫酸の合成に必要な遺伝子「Extl3」の欠損マウスを作成し、糸球体基底膜のHSPG発現を低下させることに成功した。通説が正しければ、この遺伝子欠損マウスでは多量のタンパク尿が生じるはずだが、高塩食や高タンパク食、高血糖(糖尿病化)といった負荷をかけた状態でも、尿タンパクの増加は認められなかったという。
また同マウスでは、糸球体係蹄壁の形態的変化を確認。ヒトのネフローゼ症候群の一部では、同様の形態異常が尿タンパク漏出を引き起こすと考えられてきたが、実際は直接的な原因ではないことが明らかになったとしている。
今回の研究結果は、尿タンパク漏出機構の解明に貢献することが期待される。研究グループは、「通説に一石を投じるであろう、腎臓病学の発展において非常に意義のある成果」と述べている。
▼関連リンク
・東北大学 プレスリリース



