4型コラーゲンの異常を原因とするアルポート症候群
熊本大学は3月9日、小児期に発症する遺伝性の腎臓病「アルポート症候群」の原因となるタンパク質(コラーゲン)の異常を高感度で検出する技術を確立し、その異常を是正できる治療薬開発を可能にしたと発表した。この研究は、同大大学院薬学教育部遺伝子機能応用学分野の大町紘平大学院生と、甲斐広文教授らによるもの。研究の成果は、「Cell Chemical Biology」に公開された。
画像はリリースより
遺伝性の腎臓疾患であるアルポート症候群では、原因タンパク質である4型コラーゲンの異常により、慢性的な腎機能の低下が引き起こされる。最終的には人工透析もしくは腎移植なしでは死に至り、末期腎不全に陥る重篤な疾患だ。
その治療法としては、高血圧治療に用いられるレニン・アンジオテンシン系阻害剤があり、病態の進行を抑制できることがわかっているが、4型コラーゲンの働きを是正する根本的な治療法は、未だ見つかっていない。
4型コラーゲンの状態を比較的簡便で高感度に区別
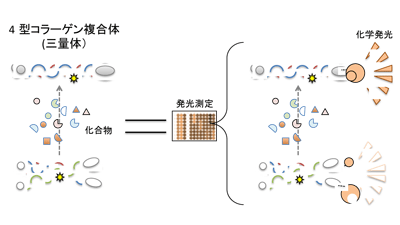
研究グループは、化合物の網羅的な評価(化合物スクリーニング)に応用可能な新しい評価システムの構築を目指した。4型コラーゲンは、α3、α4、α5鎖の3本のポリペプチド鎖(棒状のタンパク質)が複合体(三量体)を形成し、糸球体で血液成分を濾過する際、血液成分の漏出に対する物理的なバリアーとなる基底膜の構成因子となる。アルポート症候群では、そのα3、α4、α5鎖のいずれかの遺伝子に変異が生じることで、そこから産生されるポリペプチド鎖に異常が生じ、基底膜の形成不全が引き起こされることに端を発することから、遺伝子変異が生じても4型コラーゲンα3、α4、α5鎖のタンパク質の機能を補うことで、α3、α4、α5が三量体形成できるようにする化合物の探索が必要とされる。
今回、この三量体形成を評価する方法として、タンパク質-タンパク質間の相互作用解析に用いられる「split Nano luciferase技術」を採用。このシステムでは、分割された大小2つのルシフェラーゼ分子の断片をそれぞれα3、α5鎖と融合し、α4鎖と共に細胞に発現させると、α3、α4、α5鎖が三量体を形成できる条件でのみ、化学発光が検出される。
また、同システムは、これまで報告されている「α3、α4、α5鎖の決まった組み合わせで三量体を形成する」ことや、「三量体の形成に重要な機能部位を無くしたα5鎖は三量体をつくれなくなる」ことなど、既知の特性を反映していることを解明。さらに、同システムは、アルポート症候群で報告のある遺伝子変異をもったα5鎖が機能しなくなることも解析可能であり、アルポート症候群の原因となる4型コラーゲンが機能する状態と機能が失われた状態とを、比較的簡便で高感度に区別することができることも証明したという。
なお、このシステムは、治療薬候補化合物の網羅的な評価に応用可能であり、多検体を同時に解析することも可能だという。研究グループは、「これまで、根治療法がない遺伝性難病アルポート症候群治療薬開発に道筋を与えるもの」と述べている。
▼関連リンク
・熊本大学 プレスリリース



