開発が求められる耐性菌にも有効な“最後の砦”
北海道大学は2月20日、抗生物質に耐性がある菌にも効果が期待されるツニカマイシン類について、感染症への効果を維持しつつ、ヒトへの毒性を抑えた新しい化合物の合成に成功したと発表した。この研究は、同大学大学院薬学研究院の市川聡教授と、デューク大学のシー・ヨン・リー准教授らの研究グループによるもの。研究成果は、英科学誌「Nature Structural & Molecular Biology」に掲載されている。
画像はリリースより
バクテリア感染症の治療に使われる抗生物質は非常に強力だが、抗生物質の使用には、抗生物質に耐性がある薬剤耐性菌の出現が伴うため、創薬の歴史は、薬剤と薬剤耐性菌の“イタチごっこ”であると言える。薬剤耐性菌の蔓延は地球規模の深刻な問題であり、耐性菌にも有効な“最後の砦”の開発が求められている。
古くから知られている天然物の抗生物質であるツニカマイシン類は、バクテリアの細胞壁の構成成分であるリピドIを合成する酵素「MraY」を阻害し、薬剤耐性菌にも有効。しかし、ツニカマイシンはヒトの酵素「GPT」も阻害し、毒性を示すため、これまで抗生物質として用いることができなかった。
構造改変によってヒトへの毒性を約1/1000まで低下
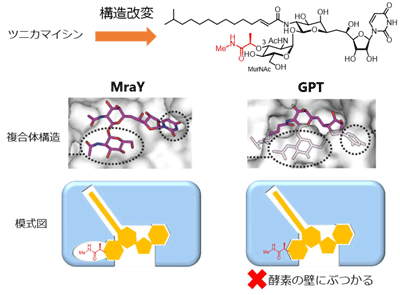
GPTは小胞体膜貫通型と呼ばれる酵素で、X線構造解析が難しいタンパク質。今回の研究では、ヒトの酵素GPTとツニカマイシンの複合体構造解明に取り組んだという。ヒトGPT遺伝子を組み込んだウイルスを昆虫細胞に感染させ、GPTタンパク質を大量発現。細胞をツニカマイシンで処理することでGPTとの複合体を形成させ、その複合体を細胞から取り出した。さまざまな結晶化条件を検討し、分解能3.1Å(オングストローム)で、得られた複合体のX線結晶構造解析に成功したという。
ツニカマイシンとMraY、GPTそれぞれとの複合体構造を比較すると、MraYには基質であるPark’s nucleotideのペプチド鎖を収納するスペースがあるが、GPTでは壁になっていることが判明。そこで、ツニカマイシンにPark’s nucleotideの一部を結合させた構造へと改変した化合物を新たに設計し、化学合成したところ、構造改変した化合物は、狙いどおりにMraY阻害活性(バクテリアへの効果)を保持しつつ、GPT阻害活性(ヒトへの毒性)が約1/1000まで低下するということが明らかになったとしている。
今回の研究で解明されたこれらの構造情報は、ツニカマイシンを基盤とした毒性の低い新しい抗生物質開発の指針となることが期待される。研究グループは「薬剤耐性菌に対する抗生物質開発の進展に繋がる大きな成果」と述べている。
▼関連リンク
・北海道大学 プレスリリース






