高い細胞増幅活性を有する内胚葉細胞
横浜市立大学は2月9日、肝臓や腸などの作製に使用可能な内胚葉前駆細胞(PGEC)の誘導・増幅方法を発見したと発表した。この研究は、同大学術院医学群 臓器再生医学の谷口英樹主任教授、同大学先端医科学研究センターの武部貴則教授(東京医科歯科大学 統合研究機構 教授)らの研究グループによるもの。研究成果は、「Stem Cell Reports」に掲載されている。
画像はリリースより
肝臓や膵臓、腸などの組織の発生学的な起源は、内胚葉と呼ばれる細胞集団であることが知られている。この内胚葉細胞は、胎児の段階では極めて少数の細胞集団だが、出生後は消化管や肝臓、膵臓などを含む大量の子孫細胞を生み出すことから、高い細胞増幅活性を有していると考えられる。しかし、試験管内において内胚葉細胞を誘導し、それらを増殖・分化誘導することはいまだ困難だった。
PGEC由来ミニ肝臓で肝不全免疫不全モデルの生存率を改善
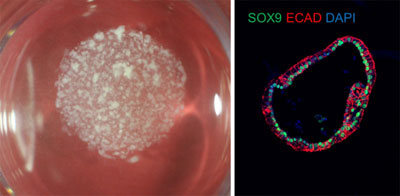
今回の研究では、内胚葉細胞の発生で重要性が示唆されているタンパク質等を組み合わせることにより、ヒトiPS細胞から後方(肛門側)マーカーのCDX2を発現する後方内胚葉前駆細胞(PGEC)を誘導。さらに、PGECの増幅培養系を確立することにより、さまざまな臓器のオルガノイドが形成可能かを検証したという。
その結果、フィーダーフリーで培養したiPS細胞について数々の培養条件を探索した結果、4段階を経て、CDX2陽性PGECが誘導できることを発見。作製したPGECは、iPS細胞と比較して、安定して肝細胞や腸細胞を分化誘導することが可能であり、さらに性質を維持したまま複数回に渡る増幅が可能であることが判明したという。また、PGECから作製したミニ肝臓を、亜急性肝不全免疫不全モデルに移植したところ、生存率の改善を示したとしている。
近年、iPS/ES細胞などの多能性幹細胞より誘導した分化細胞や組織を利用した、創薬スクリーニングや再生医療を実現化が注目されている。ヒトPGECを用いる手法は、ヒトiPS細胞から直接分化組織を得る方法と比較して、分化誘導期間が短縮されること、凍結保存ストックを作製できること、内胚葉組織の誘導のバラつきが最小化されることなどが期待される。研究グループは、「将来的にPGECの再生医療における有用性・安全性が確認されれば、安定的かつ大量の組織を得るための重要な技術基盤となることが期待される」と述べている。
▼関連リンク
・横浜市立大学 先端医科学研究センター ニュース




