医薬品の標的分子の30%を占める創薬標的「GPCR」
日本医療研究開発機構(AMED)は1月15日、医薬品の副作用のシグナルを流す状態に対応するGタンパク質共役型受容体が、膜貫通領域やリン酸化されたC末端領域が特徴的な構造を取ることを解明したと発表した。この研究は、東京大学大学院薬学系研究科および次世代天然物化学技術研究組合の嶋田一夫教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
Gタンパク質共役型受容体(GPCR)は、医薬品の標的分子の30%を占める創薬標的として極めて重要な膜タンパク質ファミリー。GPCRを標的とする医薬品は、GPCRを介し、細胞内のGタンパク質を活性化する経路と、GPCRキナーゼによるリン酸化を経てアレスチンを活性化する経路の2つのシグナル経路を制御して薬理作用を発揮する。この2つのシグナル経路の一方が医薬品の治療効果を、もう一方が副作用を誘起することが報告されている。
副作用のシグナル伝達のみを阻害することで副作用を軽減する医薬品の開発が試みられており、GPCRが副作用を起こす際に特徴的な構造を調べることが必要とされている。しかし、これまで治療効果を発揮する状態と副作用を発現する状態のGPCRの構造の違いは見出されていなかったという。
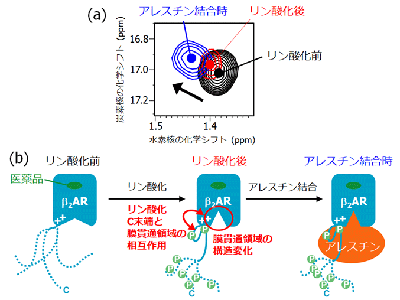
β2ARの膜貫通領域の構造が変化
研究グループは、代表的なGPCRであるβ2アドレナリン受容体(β2AR)を核磁気共鳴(NMR)で解析。副作用発現の第一段階に対応するC末端領域のリン酸化を受けた状態、およびアレスチンが結合した状態における構造を調べたという。
その結果、従来は特定の構造をとらないと考えられていたC末端領域が、リン酸化に伴ってβ2ARの膜貫通領域の細胞内側と相互作用することが判明。加えて、この相互作用を経てβ2ARの膜貫通領域の構造が変化し、この構造はアレスチンが結合した状態と類似していることがわかったとしている。
今回の結果成果は、リン酸化されたGPCRの細胞内領域で形成される分子内相互作用が、アレスチンの結合や、それに続く副作用を発現するシグナルを活性化することを示している。この相互作用を阻害するような化合物は、細胞外領域のポケットに結合する従来型の医薬品と併用することで、効果を維持しながら副作用のみを軽減させる効果を持つと考えられるという。研究グループは、「このようなメカニズムを持つ医薬品はこれまでに例がなく、GPCRを標的とした新しい医薬品開発を加速させることが期待される」と述べている。
▼関連リンク
・日本医療研究開発機構 プレスリリース




