可溶性Aβ凝集体に選択的に結合して無毒化するヒト化モノクローナル抗体
エーザイ株式会社と米バイオジェン・インク社は12月21日、抗アミロイドβ(Aβ)プロトフィブリル抗体「BAN2401」について、早期アルツハイマー病対象の臨床第2相試験(201試験)の12か月時点の解析で、主要評価項目を満たさなかったと独立データモニタリング委員会が判断したと発表した。
画像はリリースより
BAN2401は、スウェーデンのバイオアークティックABとエーザイの共同研究から得られた、アルツハイマー病に対するヒト化モノクローナル抗体。アルツハイマー病を引き起こす因子と考えられる、神経毒性を有する可溶性のAβ凝集体に選択的に結合して無毒化し、脳内から除去する。エーザイは2007年12月、バイオアークティックとのライセンス契約により、同剤の全世界におけるアルツハイマー病を対象とした研究・開発・製造・販売に関する権利を獲得。また、エーザイとバイオジェンは2014年3月に、同剤に関する共同開発・共同販促契約を締結し、2017年10月に内容の一部変更契約を締結している。
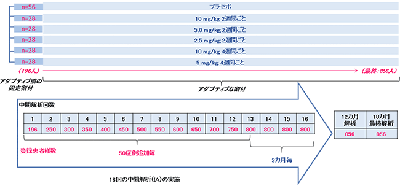
201試験は、バイオマーカーによるアミロイド陽性を確認した早期アルツハイマー病患者856人に対するBAN2401の安全性、忍容性、有効性を評価するプラセボ対照、二重盲検、並行群間比較試験。プラセボと実薬5投与群を用いて、16回の早期成功を判断する中間解析、12か月時点でのAlzheimer’s Disease Composite Score(ADCOMS)に基づく解析、18か月時点での包括的な最終解析によって、BAN2401の有効性に関する探索的評価と用量反応性を検討する。実薬群5群は、2.5mg/kg、5mg/kg、10mg/kgの3用量による2週間ごとの投与、5mg/kg、10mg/kgの2用量による4週間ごとの投与からなる。
2018年後半の最終解析で包括的評価
今回の12か月時点のBAN2401の5投与群の有効性の評価は、ADCOMSを用いて、Clinically Significant Difference(BAN2401がプラセボ群と比較して悪化を25%以上抑制)を達成する確率が80%以上かを、ベイジアン解析に基づき判定した。
両社は、事前に規定したプロトコルに従い本盲検試験を継続し、18か月時点の包括的な最終解析を行う。18か月時点の最終解析では、ADCOMSに加えて、CDR-SB(Clinical Dementia Rating Sum of Boxes)などの臨床評価指標のベースラインからの変化と共に、アミロイドPETで測定した脳におけるアミロイド蓄積量やvMRIで測定した総海馬体積などのバイオマーカーの変化など、より包括的な評価を行うという。最終解析結果は、2018年後半に得られる予定。
▼関連リンク
・エーザイ株式会社 ニュースリリース




