レクチン「rBC2LC-N」が糖鎖構造を特異的に認識
筑波大学は9月22日、膵がんの幹細胞表面に強く発現している糖鎖構造とそれを特異的に認識するレクチン「rBC2LC-N」を発見したと発表した。この研究は、同大医学医療系の下村治講師、小田竜也教授、大河内信弘教授と、産業技術総合研究所創薬基盤研究部門の舘野浩章主任研究員、平林淳首席研究員、浅島誠名誉フェローの共同研究グループによるもの。研究成果は、米国がん学会誌「Molecular Cancer Therapeutics」で先行公開されている。
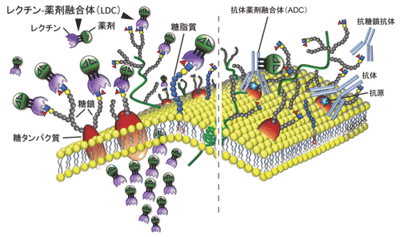
画像はリリースより
現在、抗体薬によるがん標的治療が盛んに開発されているが、標的となるタンパク質抗原はほぼ探索し尽くされており、今後大きな発展は望みにくい状況にある。さらに、患者ひとりあたり数百万~数千万円/年という抗体医薬の高額な薬価は、医療経済の破綻を招く恐れがあり、問題となっている。
今回、研究グループは、難治がん代表といえる膵がんの細胞表面を覆う糖鎖に着目。全ての細胞表面は、膜タンパク質や膜脂質が糖鎖修飾され、最外層には糖鎖が表出している。標的治療においては、奥深く存在するタンパク質を狙うよりも、最外層の糖鎖を狙った方が有効なはずだが、糖鎖構造の複雑さゆえに研究が難しく、治療標的対象としての開発は、ほとんどされていなかったという。
抗体−薬剤融合体よりも1,000倍強力な抗腫瘍効果示す
まず、研究グループは、臨床膵がんの形態、特性を保持した膵がん細胞株を選び、この細胞表面に表出している糖鎖を、産総研が開発したレクチンマイクロアレイで網羅的に解析した。その結果、H type1/3/4糖鎖構造が強く発現していることを発見。この糖鎖を認識するレクチンであるrBC2LC-Nはこの細胞株だけでなく、筑波大学附属病院で膵がんの手術を受けた患者の組織、ほぼ全例にも強く結合することが確認されたという。
次に、rBC2LC-Nレクチンが不都合な血液凝集反応をもたらすかを検討したところ、ヒト、マウスいずれの血液も凝集させることなく、安全にマウスに投与できることが明らかになったという。そこで、rBC2LC-Nレクチンを薬剤キャリアとして応用するため、rBC2LC-Nレクチンに緑膿菌の外毒素(PE38)を抗がん薬として融合したLectin Drug Conjugate(LDC)を作成。このLDCはシャーレ上の膵がん細胞株に対して、既存の抗体−薬剤融合体(ADC)よりも1,000倍強力な抗腫瘍効果を示したという。さらに、このLDCをマウスの腹腔内、血管内へ投与することで、さまざまな膵がんモデルを有効に治療することにも成功したとしている。
今回、レクチンが薬剤キャリアとして利用できる可能性が示されたことで、「抗原—抗体反応」に依存している現在のがん標的治療開発の流れに、「糖鎖—レクチン反応」という新たな代替ツールを提供することが可能になる、と研究グループは述べている。
▼関連リンク
・筑波大学 プレスリリース




