糖尿病に対する細胞移植療法の基盤となる膵芽細胞
京都大学iPS研究所(CiRA)は8月9日、ヒト多能性幹細胞(ES細胞およびiPS細胞)から膵臓細胞への分化過程を解析し、膵臓の元となる胎生期の膵芽細胞への分化を制御するメカニズムに、細胞骨格に関連する分子が関与することを明らかにした。この研究は、CiRAの豊田太郎講師、長船健二教授らによるもの。研究結果は、国際幹細胞学会(ISSCR)が発行する科学誌「Stem Cell Reports」にオンライン公開されている。
画像はリリースより
膵芽は膵臓の最初の組織であると考えられ、膵芽細胞は糖尿病に対する細胞移植療法をはじめとした膵臓再生医療の基盤となる細胞源として期待されている。
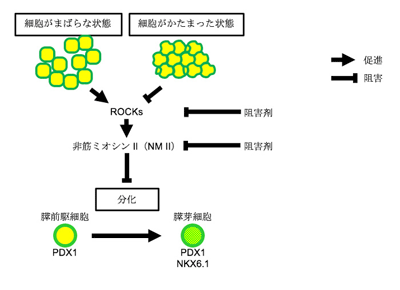
これまでに、培養皿上でヒトiPS細胞から膵芽細胞への分化には、細胞密度が高い状態での培養や、細胞の塊を作ることが有効であることがわかっているが、そのメカニズムについては不明だった。
ROCK-非筋ミオシンIIの活性化が膵臓への分化を阻害
研究グループは、細胞構造の変化に着目。細胞骨格の調節に関わる試薬の中から、ROCK阻害剤や非筋ミオシンII阻害剤が膵芽細胞への分化を促進することを見出したという。これらの薬剤の処理で作られた膵芽細胞は、マウスの生体内へ移植すると胎生期の膵臓様組織を形成し、数か月後には血中グルコース濃度に応答してインスリンを分泌することから、生体内の膵芽細胞と同様の性質があると考えられるという。また、細胞密度が高い状態や細胞塊では、ROCK活性やその下流にある非筋ミオシンIIの量が低下していることを見出したとしている。
これらの結果から、ROCK-非筋ミオシンIIというシグナル伝達の活性化は、培養皿上での実験において、膵臓への分化を阻害すると考えられる。今回の研究は、糖尿病などの膵臓疾患に対するiPS細胞を用いた再生医療開発研究の基盤として、今後の研究に期待が寄せられる。
▼関連リンク
・京都大学iPS研究所 ニュース




