がん転移のステップとして知られる上皮間葉転換
東京医科歯科大学は6月22日、独自のEMT可視化システムとマイクロRNAライブラリーを組み合わせることにより、上皮間葉転換(EMT)を制御するマイクロRNA(miRNA)を同定したと発表した。この研究は、同大難治疾患研究所・分子細胞遺伝分野の村松智輝助教、稲澤譲治教授ら研究グループによるもの。研究成果は、国際科学雑誌「Scientific Reports」オンライン版で発表されている。
画像はリリースより
上皮間葉転換(EMT:Epithelial Mesenchymal Transition)は、がん転移のステップの一部として知られている。EMTは、上皮系の細胞が、間葉系形質を獲得する現象であり、間葉系形質を獲得したがん細胞は移動・浸潤能が亢進し、がん転移を起こしやすいと考えられている。EMTを促進する遺伝子やEMTとは逆方向の間葉系形質から上皮系形質へ誘導する(MET: Mesenchymal Epithelial Transition)遺伝子も、数多く報告されており、その分子機構は徐々に解明されてきている。
miR-509-5pとmiR-1243が異なる経路でEMTを抑制
今回の研究では、独自に開発したレポーターシステム(EMT可視化システム)と1,090種類のmiRNAを搭載したmiRNAライブラリーを組み合わせた大規模EMT 関連miRNAスクリーニングを用いて、EMT抑制性のmiRNAを同定することを目的として解析を実施した。
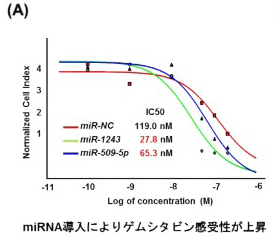
その結果、EMTにかかわる2種類のmiRNAとして「miR-509-5p」と「miR-1243」を同定。miR-509-5pとmiR-1243は、それぞれ異なる経路でEMTを抑制することが明らかになった。さらに、これらmiRNAを介して、EMT を抑制することで、膵がん治療で最も使用される抗がん剤のゲムシタビンの効果が上昇することも判明したという。
今回の研究で同定したmiR-509-5pとmiR-1243のがん組織中での発現を調べることにより、予後のバイオマーカーとしてだけではなく、抗がん剤の効果を予測することができる可能性がある。また、これらmiRNAを対象とした核酸薬が開発されれば、がん組織中においてこのmiRNAの発現がない場合でも、抗がん剤との併用治療を行うことにより、腫瘍抑制効果を増強できる可能性がある、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレス通知資料




