病原体含有小胞に包まれ、分解を逃れている病原体
大阪大学は6月13日、Gate-16(ゲート16)という宿主分子が病原体含有小胞を形成する寄生虫「トキソプラズマ」や、細菌「サルモネラ」のインターフェロンによる効率的な排除に必須であることを発見したと発表した。この研究は、同大微生物病研究所の山本雅裕教授らの研究グループによるもの。研究成果は、英科学雑誌「Nature Immunology」に6月12日付けでオンライン掲載されている。
画像はリリースより
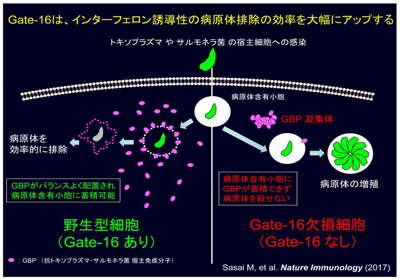
トキソプラズマやサルモネラなどの病原体は、感染した宿主細胞内では膜構造体である「病原体含有小胞」に包まれた状態で存在し、宿主による分解を逃れている。そのような病原体に対して宿主は、インターフェロンに依存した免疫反応を起こして、病原体含有小胞を破壊して対抗している。研究グループは2012年、インターフェロンによって誘導されるGBP(p65 GTP 分解酵素)が病原体含有小胞を破壊し、トキソプラズマの発病を抑えていることを解明していた。しかし、この免疫反応がどのように効率的に制御されているのかについては不明だった。
GBPがGate-16依存的に「遍在」することが抗病原体応答に重要
今回、同研究グループは、Gate-16を欠損すると、インターフェロンガンマ刺激をしてもGPBの病原体含有小胞への蓄積が著しく低下し、病原体数が減少しないことを解明。また、GBPがGate-16依存的に細胞質内に均一に遍在することが、抗病原体応答に重要であることがわかったという。
さらに、マウスの実験において、Gate-16欠損マウスはトキソプラズマに対して劇的に高い感受性を示し、原虫の数が野生型に比べ劇的に増加していたことが明らかとなった。これにより、個体レベルでもGate-16が抗病原体応答に重要であることが示唆されたという。
今回の研究によって、Gate-16は抗トキソプラズマ・サルモネラ宿主免疫分子GBPを細胞質内であらかじめバランスよく配置することで、病原体がどこから侵入してきてもGBPと遭遇するように用意し、抗病原体応答を効率的に引き起こしていると考えられる。今後、Gate-16の活性を人為的に制御することで、トキソプラズマ症やサルモネラの食中毒の発病を食い止める、新規の治療・予防戦略の開発に期待が寄せられる。
▼関連リンク
・大阪大学 研究情報






