小胞体関連分解を促進させる「ERdj5」
東北大学は4月28日、X線結晶構造解析により、ジスルフィド結合開裂酵素「ERdj5」のクラスターの配向が異なる2つの結晶構造を解明したと発表した。この研究は、同大学の稲葉謙次教授、熊本大学の小椋光教授、京都産業大学の永田和宏教授らの研究グループによるもの。研究の成果は、「Structure」オンライン速報版に5月4日付で掲載されている。
画像はリリースより
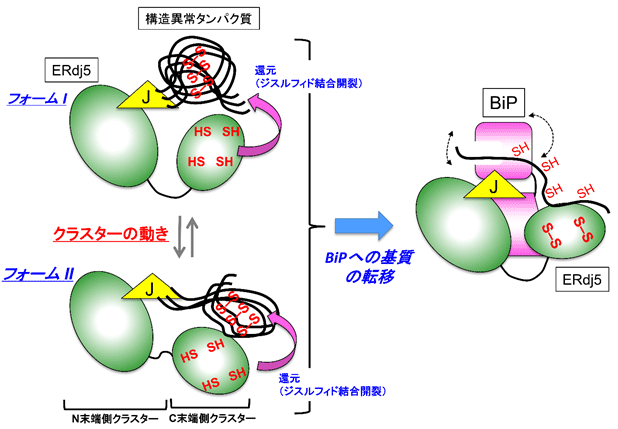
細胞内には、正常なタンパク質の高次構造形成反応を促進する仕組みがある一方で、 構造異常のタンパク質を速やかに分解・除去するための巧妙な品質管理システムも存在している。Protein Disulfide Isomerase(PDI)ファミリータンパク質の1つであるERdj5は、哺乳動物細胞の小胞体中で誤って形成されたジスルフィド結合を還元し、小胞体関連分解と呼ばれる分解機構を促進させる役割を担っている。
ERdj5の全体構造はそれぞれが複数のドメインから構成されてる2つのクラスター「N末端側クラスター」と「C末端側クラスター」があり、両クラスターは、フレキシブルなリンカー領域で連結されていることから、動きに富むことが示唆されていた。しかし、この動きがERdj5の機能発現にどう関わるか不明だったため、詳細な分子機構はわかっていなかったという。
神経変性疾患などの原因を分子構造レベルで解明できる可能性
研究グループは、X線結晶構造解析という手法により、ERdj5がN末端側クラスターとC末端側クラスターの配向が大きく異なる、2つのコンフォメーションをとることを解明。さらに、分子の動きを一分子レベルで観察する高速原子間力顕微鏡(高速AFM)を用いて、ERdj5のC末端側クラスターがN末端側クラスターに対して高速に動いている様子を世界で初めて観察することに成功した。
これら一分子レベルでの観察により、ERdj5のC末端側クラスターの自由度が、誤って形成されたジスルフィド結合の還元に必要であることがわかったという。
パーキンソン病やアルツハイマー病など種々の神経変性疾患は、体内で不良品タンパク質が過剰に蓄積することで引き起こされる。今回の研究で得られた知見は、神経変性疾患や2型糖尿病などに対する分子構造レベルでの原因解明につながる可能性があるとして、今後の研究に期待が寄せられている。
▼関連リンク
・東北大学 プレスリリース




