Ras遺伝子を介したがんの悪性化にDOCK1が重要な役割
九州大学は5月8日、がん遺伝子Rasを介したがんの悪性化に、DOCK1というタンパク質が重要な役割を演じていることを発見し、その選択的阻害剤「TBOPP」を世界に先駆けて開発したと発表。DOCK1阻害により、がんの増殖および転移を抑制できることを実証したという。この研究は、同大生体防御医学研究所の福井宣規主幹教授、宇留野武人准教授、大学院医学系学府博士課程4年生の田尻裕匡大学院生らの研究グループが、東京大学大学院薬学系研究科の金井求教授、理化学研究所の横山茂之上席研究員の研究グループと共同で行ったもの。研究成果は、米科学雑誌「Cell Reports」に5月2日付けで掲載されている。
画像はリリースより
Rasはヒトにおいて最初に同定されたがん遺伝子であり、その変異は、がん全体の3分の1に認められるともいわれている。しかし、現在、変異Rasを持つがんに対する有効な治療薬は開発されておらず、その対策は急務となっている。
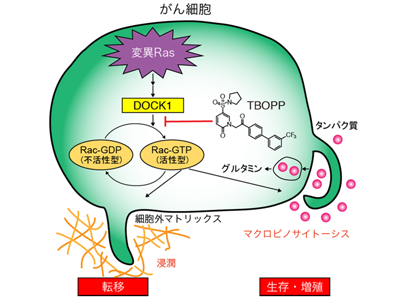
正常細胞のRasは「分子スイッチ」として機能しており、細胞外から刺激を受けた場合にのみ、不活性型(スイッチOFF)から活性型(スイッチON)に変換され、増殖や生存といった細胞活動を支える働きをしている。一方、変異によってRasが常時活性型になると、がん細胞はマクロピノサイトーシスを介して細胞外からの栄養分の取り込みを促進させ、低栄養条件下でも生存・増殖できるように変化。周辺組織に浸潤し、血管やリンパ管を介して遠隔転移する。
変異Rasを有するがん細胞の増殖・転移を抑制
研究グループは、変異Rasによるがんの生存および浸潤には、RacというRasと同様に分子スイッチとして機能する分子の活性化が必要であることに着目。その制御因子であるDOCK1の機能を解析した結果、DOCK1を発現できないように遺伝子操作したがん細胞では、低栄養条件下での生存性および浸潤能が著しく低下することを見いだした。また、DOCK1の変異体を用いた解析から、DOCK1のRacを活性化する機能がこれらの細胞応答に重要であることもわかったという。このことから、変異Rasによるがん細胞の浸潤や生存応答において、DOCK1-Rac経路が重要な働きをしていることが明らかになった。
DOCK1には免疫細胞の遊走・活性化に重要なDOCK2という近縁分子が存在することから、がん治療のためには選択的にDOCK1を阻害することが必要となる。そこで、20万を超える化合物ライブラリーをスクリーニングし、ヒット化合物の構造最適化を実施。DOCK1の選択的阻害剤「TBOPP」の開発に成功した。TBOPPで処理したがん細胞は、DOCK1欠損細胞の場合と同様に、浸潤応答やマクロピノサイトーシス、低栄養条件下での生存性が顕著に抑制。一方、免疫細胞の運動にはDOCK2を介したRac活性化が重要だが、TBOPPは同じ濃度で、免疫細胞の動きには全く影響を与えなかったという。このことから、TBOPPは、細胞レベルにおいてもDOCK1とDOCK2を識別していることが明らかになった。実際、TBOPPをマウスに投与することで、変異Rasを有するがん細胞の増殖および転移が抑制できることも確認されている。
以上の結果により、TBOPPは、がんを兵糧攻めにすると同時に、その浸潤・転移を未然に防ぐことができる化合物であることが判明した。研究グループは、今回の研究結果が、変異Rasを有する難治性がんに対する画期的な治療薬の創出につながるものと期待を寄せている。
▼関連リンク
・九州大学 プレスリリース




