細胞の損傷を免疫系に知らせる脂質を
九州大学は4月4日、グルコシルセラミドと呼ばれる生体内の脂質が、ミンクルという免疫受容体に結合し、免疫系を活性化する役割があることを発見したと発表した。この研究は、同大生体防御医学研究所、大阪大学微生物病研究所の山崎晶教授らの研究グループによるもの。研究成果は「Proc. Natl. Acad. Sci. USA」オンライン版に4月3日付けで掲載されている。
画像はリリースより
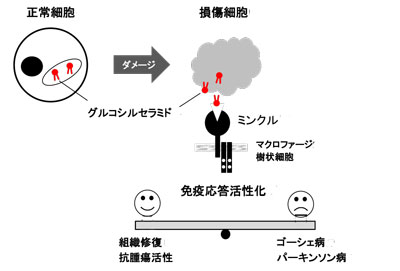
免疫系は、外来からの病原体のみならず、自己の細胞が障害を受けた際にも活性化し、損傷部位を取り除くはたらきを担うことがわかっている。研究グループは2008年に、細胞死を感知して免疫系を活性化する受容体として、ミンクルと呼ばれる活性化受容体を同定していたが、死細胞の「何」を認識しているのかに関しては不明な部分が多かった。
研究グループは並行研究で、ミンクルが病原体の脂質を認識する性質を持つことを見出したことから、細胞の損傷に伴って放出される何らかの脂質が重要なのではないかと考えたという。そこで、死細胞を培養した培養液から脂質成分を抽出し、ミンクルに結合する活性があるかを調査。その結果、ある分画に特異的な活性があることを見出し、その成分がグルコシルセラミドという脂質であることを発見した。グルコシルセラミドは通常、細胞内に存在する糖脂質だが、細胞の損傷に伴って細胞外に放出されることがわかったという。実際に、グルコシルセラミドをマウスに投与すると免疫系が活性化され、ミンクルを欠損させるとその効果が失われることも判明した。
ミンクルを効率よくブロックできる阻害抗体などの開発へ
グルコシルセラミドは、生体内で蓄積するとゴーシェ病やパーキンソン病を引き起こすことが知られている。そこで研究グループは、マウスの疾患モデルを用いて検討したところ、グルコシルセラミド蓄積を伴う炎症応答の増悪は、ミンクルを欠損させることで改善されることが明らかになったという。これらの研究から、自己組織の損傷を感知し、免疫系活性化に繋げる分子メカニズムが明らかになった。また、グルコシルセラミドの過剰な蓄積がなぜ炎症を増悪させ、疾患の原因になるのかも解明された。今後、ミンクル-グルコシルセラミド経路は、ゴーシェ病、パーキンソン病の新たな治療薬の標的としても期待される。
研究グループは、治療薬開発に繋げていくためには、ゴーシェ病やパーキンソン病の動物モデルでミンクルを阻害した場合に、どのような治療効果が得られるかを詳細に調べていくことが必要であり、ミンクルを効率よくブロックできる阻害抗体や低分子アンタゴニストの開発を行っていくとしている。
▼関連リンク
・九州大学 研究成果






