SCA31は異常なRNAくりかえし配列のRNA毒性によって起きる
東京医科歯科大学は3月24日、日本人特有といわれる遺伝性脊髄小脳変性症「SCA31」を引き起こす長いRNAくりかえし配列の神経毒性が、筋萎縮性側索硬化症(ALS)の原因蛋白であるTDP-43やFUS, hnRNPA2/B1によって緩和されることをつきとめたことを発表した。この研究は、同大学医学部附属病院長寿・健康人生推進センターの石川欽也教授、同大学の特命教授で国立精神・神経医療研究センターの水澤英洋総長、同大学大学院医歯学総合研究科脳神経病態学分野の横田隆徳教授の研究グループが、国立精神・神経医療研究センター、ストラスブール大学、トロント小児病院などと共同で行ったもの。研究成果は、国際科学誌「Neuron(ニューロン)」オンライン版に掲載された。
画像はリリースより
脊髄小脳失調症31型(SCA31)は、日本人に特有といわれ、日本において比較的高頻度に存在する常染色体優性遺伝性の脊髄小脳変性症。日本における患者数は、2,000~4,000人程度と推定されている。
同大学は、この疾患の原因が患者にだけ存在するDNAの5塩基くりかえし配列であることを2009年に発見。また、SCA31患者の神経細胞には、5塩基くりかえしがRNAに転写され、異常な高次構造(RNA foci)を形成していることを見出していた。タンパク質の凝集が根本現象となる神経疾患は以前から多数知られており、その代表としてアルツハイマー病、パーキンソン病、ALSなどがあるが、最近、SCA31と同じようにRNAの異常な凝集が原因となる神経難病が多数発見されている。
脊髄小脳変性症やALSでは、RNAとタンパク質のバランスが破綻
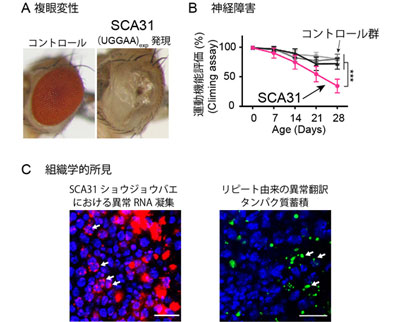
研究グループは、SCA31由来の5塩基くりかえし配列DNAを導入したSCA31モデルショウジョウバエを作製。変異RNA(UGGAA)expの発現により、進行性の運動障害と複眼変性が生じることを明らかにした。このショウジョウバエでは、患者脳と同様に異常なRNAの高次構造体RNA fociが検出され、また変異RNAからは「リピート由来の翻訳タンパク質(PPR)」も発現していたことから、RNA fociとPPRの両方がSCA31モデルショウジョウバエでの病態に関与していると考えられたという。
この変異RNAに結合するタンパク質を多数同定したところ、その中にALSの原因蛋白であるTDP-43, FUS, hnRNPA2/B1などが含まれていた。患者脳で認められるRNA fociにもTDP-43が共局在しており、TDP-43はSCA31のRNAくりかえし配列に結合してRNAの構造変化を引き起こすことが判明したという。
さらに、SCA31ショウジョウバエとTDP-43を発現する別のショウジョウバエを交配したところ、TDP-43の発現によりSCA31ショウジョウバエの複眼変性が修復され、組織中のRNA fociおよびPPRの蓄積が減少、細胞毒性が緩和されたことから、TDP-43はRNAの構造異常を抑制するRNAシャペロンとして機能することを見出したという。一方で、変異を有するALSの原因タンパク質(変異TDP-43)を発現するALSモデルショウジョウバエに対しては、SCA31の変異RNAと同じ配列で毒性のない短いRNA(UGGAA)22の発現により変異TDP-43の凝集が抑制され、ALSモデルショウジョウバエの複眼変性が改善することを発見したという。
研究グループは、RNAとRNA結合タンパク質との相互作用によりRNA結合タンパク質がRNAの構造異常を抑制する一方、RNAはRNA結合タンパク質の凝集を抑制するという生体内でのバランス機構の存在が示唆されたとし、このRNA/タンパク質のバランスの不均衡が、異常RNAの蓄積を認めるSCA31やRNA結合タンパク質の凝集を伴うALSを引き起こすという新しい病態仮説を提唱し、このバランスの不均衡を是正するという全く新しい治療手段の可能性にも言及。同研究成果が、各種RNAやRNA結合タンパク質が凝集蓄積する多様な神経変性疾患の治療薬や治療戦略の足がかりとなるとしている。
▼関連リンク
・東京医科歯科大学 プレスリリース




