ES細胞やiPS細胞を用いた再生医療の発展に貢献
広島大学は3月10日、心臓の流出路、左心室、心房、静脈洞へ、つまり右心室以外の心臓を構成する新たな心臓前駆細胞を同定したと発表した。この研究は、同大学大学院医歯薬保健学研究院の小久保博樹講師、同大学医学部MD-PhDコースの学生であった藤井雅行博士、吉栖正生教授らと、国立遺伝学研究所の相賀裕美子教授らの共同研究によるもの。研究の成果は「Nature Communications」に掲載された。
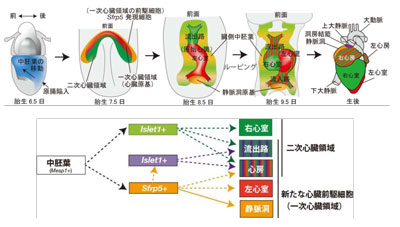
画像はリリースより
近年、心臓病は日本において、悪性腫瘍に次ぐ第2位の死因となっているため、再生医療の早期実現化が期待されている。心筋は分化した後に増殖能を持たないため、高い増殖および分化能を持つiPSやES細胞などの幹細胞が、心筋再生の細胞源として期待されている。再生医療の早期実現のためには、各々の心筋を安定的に得ることのできる誘導法の確立が必須だ。
固有心筋だけでなく特殊心筋が分化誘導する重要な技術的基盤に
心筋は、心房や心室を構成する固有心筋と刺激伝導系を構成する特殊心筋とからなる。今回研究グループは、右心室以外の心臓を構成する細胞へ分化する、共通の心臓前駆細胞(Sfrp5遺伝子を発現する細胞)を同定。Sfrp5遺伝子を発現した細胞が、固有心筋から成る右心室以外の心筋と、刺激伝導系の一部が形成されることが知られている静脈洞へと分化することを明らかにした。また、Sfrp5遺伝子発現細胞が、心臓の流出路から右心室にかけての領域の一部へも寄与することも判明。これまで明らかになっていなかった静脈洞の前駆細胞を含むことも明らかとなったという。
Sfrp5遺伝子を発現する心臓前駆細胞の性状を詳細に解析することで、各心筋へと分化するために必要な転写因子群やシグナルカスケードが明らかになるという。研究グループは、心房や心室を構成する固有心筋と、刺激伝導系を構成する特殊心筋の両心筋の誘導法の確立を目指したいとし、今後、固有心筋だけでなく特殊心筋が分化誘導する重要な技術的基盤となり、ES細胞やiPS細胞を用いた再生医療の発展に貢献することが期待されると述べている。
▼関連リンク
・広島大学 研究成果






