アシルセラミド産生に関わる遺伝子の同定成功
北海道大学は3月2日、皮膚バリアに最も重要な脂質(アシルセラミド)の産生に関わる遺伝子(PNPLA1)を同定し、アシルセラミド産生の分子機構の全容を解明したと発表した。この研究は、同大学大学院薬学研究院の木原章雄教授らの研究グループによるもの。同研究成果は、英国の「Nature Communications」に3月1日付けで公開されている。
画像はリリースより
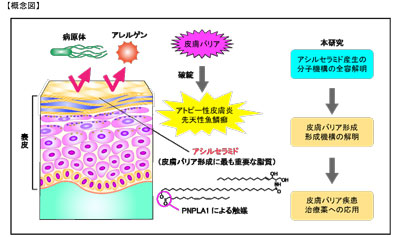
人体は常に外界の病原体や汚染物質の侵入の脅威に曝されており、皮膚によるバリアはその最大の防御機構だ。この皮膚バリアの本体は脂質であり、皮膚の最も外側にある角質層に脂質の多層構造体が存在する。脂質とは生体の水に溶けない物質の総称で、皮膚には皮膚にしか存在しない特殊な脂質アシルセラミドが存在し、近年の研究から、このアシルセラミドこそが皮膚バリアの機能に最も重要な脂質であることがわかっていた。
アトピー性皮膚炎患者ではアシルセラミド量が低下する。また、アシルセラミドが合成できない遺伝子異常は、先天性魚鱗癬と呼ばれる重篤な皮膚疾患を引き起こす。アシルセラミドの存在自体は30年以上も前から知られており、その重要性も認められてきたにもかかわらず、生体内でアシルセラミドがどのように作られるのかは長年明らかにされてこなかった。
研究グループでは、これまでにアシルセラミドの産生経路の中間体の解明や、化学反応の順序の解明、数々のアシルセラミド関連酵素遺伝子の同定に成功している。しかし、アシルセラミド産生の最終ステップに関わる酵素遺伝子の同定は、不明なまま残されていた。
皮膚バリア増強による皮膚疾患治療薬の開発に期待
アシルセラミド産生は複数のステップからなり、各ステップに関わる遺伝子は表皮の角化細胞が分化した時に発現するのみで、通常の細胞には発現していない。一方、分化した角化細胞には遺伝子導入効率が低いという実験上の扱いづらさがあり、このことが長年にわたりアシルセラミド合成関連遺伝子の同定を阻んできた一因だった。
このような背景の中、同研究グループは遺伝子導入効率がよい一般的な培養細胞中に同定してきた遺伝子群を導入することによって、アシルセラミドを産生できる系を確立。この細胞系を用いることで、今回アシルセラミド産生の最終ステップを触媒する酵素遺伝子として、PNPLA1の同定に成功した。
PNPLA1タンパク質はオメガ水酸化セラミドに脂肪酸であるリノール酸を付加してアシルセラミドを作り出す反応を触媒する。研究グループは、このリノール酸の供給源がトリグリセリドであること、PNPLA1タンパク質がトランスアシラーゼと呼ばれる酵素に分類されることも生化学的な手法によって明らかにした。また、PNPLA1は先天性魚鱗癬の原因遺伝子として知られていたが、今回の結果によって遺伝子変異と病態の関連も明らかになったという。
皮膚疾患の有効な治療薬の開発には、病気の原因となっている皮膚バリアの回復が不可欠だ。アシルセラミド産生の分子機構の全容が解明されたことで、今後アシルセラミドの産生を増強する化合物の探索を行うことが可能となり、皮膚バリア増強という新たな方策による皮膚疾患治療薬の開発が期待される。
▼関連リンク
・北海道大学 プレスリリース






