C9ORF72と小胞輸送を担うRAB7L1 GTPアーゼとの相互作用の破綻が関与
国立精神・神経医療センター(NCNP)は3月1日、C9ORF72の非翻訳領域リピート異常伸長が原因の、筋萎縮側索硬化症(ALS)および前頭側頭型認知症(FTD)の病態に、C9ORF72と小胞輸送を担うRAB7L1 GTPアーゼとの相互作用の破綻が関与することを明らかにしたと発表した。この研究は、同センター神経研究所遺伝子疾患治療研究部の青木吉嗣室長らの研究グループによるもの。研究成果は「BRAIN」オンライン版に2月23日付けで掲載され、BRAIN誌2017年4月号の注目論文(Editor’s Choice Article)に選出された。
画像はリリースより
ALSは主に中年以降に発症し、上位運動ニューロンと二次運動ニューロンが進行性に変性・消失することにより、次第に筋肉がやせて力が弱くなる難治性の運動ニューロン疾患。一方、FTDは物忘れや性格の変化、言語や行動の障害などをひき起こす認知症だ。2011年には、C9ORF72遺伝子の非翻訳領域のGGGGCCリピート配列の異常伸長が、孤発性および家族性ALSおよびFTDの原因として最も多いことが報告されている。
また、最近、C9ORF72遺伝子の非翻訳領域に存在する6塩基(GGGGCC)配列の異常伸長が、家族性および孤発性のALSおよびFTDの主な原因であると報告された。しかし、このC9ORF72関連ALS/FTDの病態については、6塩基配列の異常伸長が原因のRNA毒性や、ハプロ不全等を病因とする仮説が提示されていたものの、C9ORF72タンパク質の機能と、非翻訳領域(イントロン1)の6塩基配列の異常伸長が神経変性をひきおこす分子機序は不明だった。
C9ORF72関連ALS、認知症の新規核酸治療法開発につながる期待
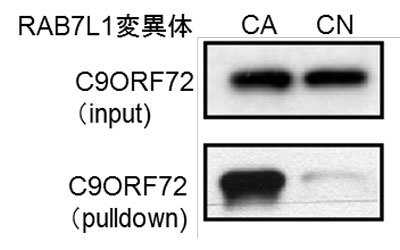
研究グループは、C9ORF72関連ALS/FTD患者由来の線維芽細胞とiPS運動ニューロンでは、エクソソーム等の細胞外小胞分泌数の減少と、マンノース6-リン酸受容体局在で評価したトランス・ゴルジ網の異常を認めることを発見。患者由来iPS運動ニューロンを用いたウエスタンブロット解析で、C9ORF72タンパク質の有意な減少を認めたという。さらに、GSTタグ付きの42種類のRAB1-43を用いた共免疫沈降法により、C9ORF72とRABタンパク質との分子間相互作用を網羅的に解析したところ、C9ORF72はRAB7L1(RAB29)GTPアーゼと強い分子間相互作用を示すことを見出した。RAB7L1 GTPアーゼの活性化型固定化変異体(CA)、あるいは不活性化型固定化変異体(CN)を用いた共免疫沈降法により、C9ORF72はRAB7L1 GTPアーゼのCA変異体と強い分子間相互作用を示すことが判明したという。
同センター遺伝子疾患治療研究部ではこれまでにも、難治性のデュシェンヌ型筋ジストロフィー(DMD)のモデル動物を対象に、エクソン・スキップの基盤的研究を実施し、モルフォリノ核酸の用量依存的な効果と高い安全性を実証してきた。2015年までに完了したエクソン53スキップ薬の医師主導治験の成果を受けて、DMD治療剤NS-065/NCNP-01(エクソン53スキップ薬)は、厚生労働省の先駆け審査指定制度の対象に初指定され、現在、国内第1/2相試験および米国第2相試験が同時進行している。
今回の研究は、難治性のC9ORF72関連ALS/FTDに対して、新規病態解明に基づいた治療法開発の道を拓くものであり、今後、DMD以外の難治性神経・筋疾患を対象にした核酸医薬品の開発が加速することが期待されると、研究グループは述べている。
▼関連リンク
・国立精神・神経医療センター(NCNP) プレスリリース




