ヒト赤血球の細胞変形能を担う細胞骨格が緩和する時定数を発見
大阪大学は2月24日、ヒト赤血球細胞への変形負荷の時間を精密制御することで、細胞内部の細胞骨格が負荷に応じて再構成する新たな時間スケールを発見したと発表した。この研究は、同大学大学大学院工学研究科の金子真教授、名古屋大学マイクロ・ナノメカトロニクス研究センター新井史人センター長、独ハイデルベルグ大学物理化学研究所・京都大学物質-細胞統合システム拠点の田中求教授らの研究グループによるもの。研究成果は、英科学誌「Scientific Reports」オンライン版に掲載された。
画像はリリースより
血流や血管壁など周囲の環境に応じて大きく変形する赤血球の「変形に対する動的応答」は、細胞の生命機能解明につながるだけでなく、健康な血液循環を診断するためにも重要な研究対象。近年ではナノ・マイクロ加工技術が発展し、高速計測も可能なことから、毛細血管を模したマイクロ流路を用いてその変形能を評価する試みが数多く行われてきた。しかし、微小な流路トンネルの内部で赤血球への変形負荷強度を制御することは技術的に難しい課題だったという。
血液疾患の迅速な物理学的診断が可能に
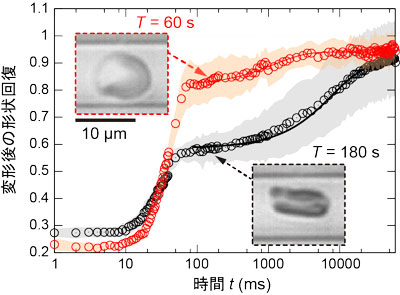
研究グループは、マイクロ流路にロボットポンプを接続したシステムを用いて、変形時間を自在に制御することにより、高速な計測を行いながら、新たな変形能の特性を引き出すことに成功。10~300,000msの極めて広い時間範囲でさまざまな変形負荷を与え、従来知られていた100ms程度の速い形状回復と、数10min程度の極端に遅い形状回復の間に位置する、10s程度の遅い形状回復が存在することを発見した。「変形負荷がかかっている時間」に関する網羅的な評価は世界初であるという。
10s程度の遅い形状回復は、180s程度の変形負荷時間をかけたときに得られるもので、細胞の変形能を激変させる。この変形負荷時間は、内部構造である細胞骨格の働きに特徴的なATP依存性を示すことから、変形しているひとつの細胞内での細胞骨格の組み換わりに由来する時間スケールであることが明らかになった。さらに、この時定数が敗血症因子を作用させた赤血球では異常化し、健康な赤血球とは異なる時定数へとシフトすることを発見したという。
今回の研究により、赤血球細胞の変形能を担う細胞骨格の再構成メカニズムと、健康な血液循環を維持している生命原理・機構の一端が明らかになった。今後は、敗血症をはじめ血液の関係するさまざまな病気で見られる赤血球の変形能異常を、高速かつ定量的に検出できる新しい力学的診断法への応用に期待が寄せられる。
▼関連リンク
・大阪大学 研究情報




