高い効率でウイルスを伝播するcell-to-cell感染のメカニズムを解明
横浜市立大学は1月31日、エイズの原因となるヒト免疫不全ウイルス(HIV)が体内で効率よく感染を拡げるための分子メカニズムを解明し、これに関わる宿主タンパク質を発見したと発表した。この研究は、同大学学術院医学群微生物学の梁明秀教授、宮川敬助教らと、国立感染症研究所、シンガポール国立大学、北里大学、米国ミシガン大学などとの共同研究によるもの。研究成果は英科学誌「Nature Communications」に1月30日付けで掲載されている。
画像はリリースより
HIVが体内で多量に増殖するメカニズムとしては、感染細胞から放出されたウイルス粒子が別の細胞に感染する「cell-free感染」と、感染細胞と非感染細胞が直接接触することにより一度に大量のウイルスを受け渡す「cell-to-cell(細胞−細胞間)感染」という仕組みが知られている。一般的にcell-to-cell感染はcell-free感染に比べ、数十倍~数千倍も高い効率でウイルスを伝播することが可能とされている。
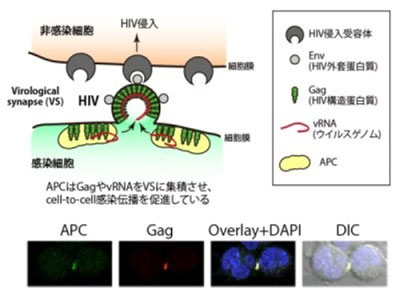
cell-to-cell感染は、細胞生物学的には細胞と細胞の接合部に存在するVirological Synapse(VS)と呼ばれる特殊な構造体を介して起こる。VSはウイルスの受け渡し場所としての役割を果たしているため、HIVの効率的な伝播には、構造タンパク質GagやウイルスゲノムvRNAなどのウイルスの基本構成要素をVSまで輸送することが重要となる。また、HIVが極性を有する感染細胞から放出される場合、一定の方向からのみ放出されることも知られている。しかし、これら一連のメカニズムや宿主タンパク質の役割については、これまでほとんど解明されていなかった。
ウイルス-宿主間相互作用を抑制する新しいタイプの治療薬開発へ
研究グループは、HIV粒子形成に関わる重要なステップのひとつであるGagタンパク質とvRNAの細胞膜への輸送に着目。これまでの研究から、GagとvRNAの輸送は一部共通の宿主タンパク質を介している可能性があると考えられており、それらを司る宿主因子が同定されれば新たな治療標的となりうると考え、TAP(Tandem Affinity Purification)を用いたプロテオミクス解析により、Gagに結合する宿主因子の探索を試みた。その結果、がん抑制遺伝子産物であるAPC(adenomatous polyposis coli)を同定することに成功したという。
APCは極性細胞の突端部に局在し、さまざまなタンパク質やRNAの局在や制御に関与することが明らかとなっている。そこで研究グループは、Gag、vRNAの輸送や制御にAPCがどのように関わるのかを検討。その結果、ウイルス感染細胞にAPCを過剰発現させると、HIV産生量が約6倍に上昇したという。特に、家族性大腸腺腫症由来のAPC遺伝子変異細胞に野生型APCを過剰発現するとHIV産生量が約10倍以上亢進。さらに、蛍光標識したGagやvRNAを用いてHIVのcell-to-cell感染について観察したところ、APCはGagおよびvRNAとともにVSに集積することがわかった。一方、APCを発現抑制した細胞では、VSへのGagとvRNAの集積が減少し、それに伴いHIVのcell-to-cell感染伝播効率が顕著に低下したという。これらの結果から、APCはウイルス構成因子であるGagおよびvRNAをVSに集積、安定化させることで、HIVのcell-to-cell感染を制御している宿主タンパク質であることが示唆された。
APCはがん抑制因子であるため、完全にその機能を抑制することは望ましくないことから、APC本来の機能を阻害せずにGagとの相互作用を阻止できれば、HIVの効率的なcell-to-cell感染が阻止できる可能性がある。研究グループは今後、APCのGag結合領域を模倣したペプチドや化合物、さらにはAPCとGagの相互作用を抑制する化合物などを探索することで、ウイルス-宿主間相互作用を抑制する新しいタイプの治療薬開発へ展開させたいとしている。
▼関連リンク
・横浜市立大学 ニュース






