Lhx3、Ngn2、Isl1の3つの転写因子を搭載したSeVベクター
京都大学iPS細胞研究所(CiRA)は2月2日、センダイウイルス(SeV)ベクターを用いてES細胞/iPS細胞から脊髄運動ニューロンへと分化させる技術を確立したと発表した。この研究は、同大学大学院医学研究科臨床神経学の後藤和也大学院生、CiRA増殖分化機構研究部門の今村恵子助教らの研究チームによるもの。研究成果は、米国科学誌「Molecular Therapy – Methods & Clinical Development」にオンライン公開された。
画像はリリースより
筋萎縮性側索硬化症(ALS)は、脊髄運動ニューロンの異常が原因の代表的な疾患のひとつ。これまでALSについての多くの研究が発表されてきたが、病気の鍵となるメカニズムはまだ解明されておらず、満足のいく治療法は確立されていない。近年、ES細胞/iPS細胞を用いた、ALSなどの脊髄運動ニューロン疾患の研究における新たなアプローチが始まっている。
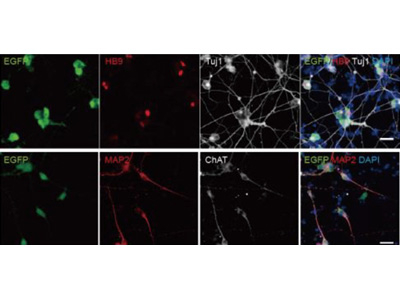
研究チームは、LIM/homeobox protein 3(Lhx3)、Neurogenin 2(Ngn2)、Islet-1(Isl1)という3つの転写因子を搭載したSeVベクターを用いて、ES細胞やiPS細胞を脊髄運動ニューロンへワンステップで簡便に分化させる技術を確立した。SeVベクターを用いてES細胞/iPS細胞にLhx3、Ngn2、Isl1を導入し、脊髄運動ニューロンを作製。SeVベクターが導入された細胞の中で、脊髄運動ニューロンの割合は90%以上だったとしている。
脊髄運動ニューロンを簡便に作製することを可能に
また、分化開始2日で脊髄運動ニューロンのマーカーが発現してくることがわかった。脊髄運動ニューロンのマーカーであるHB9が発現すると緑色に光るiPS細胞に、SeVで転写因子を導入し、ライブイメージングを行い、どのくらいの速さで脊髄運動ニューロンができるかを調べた。すると、約48時間で細胞が緑色に発光し、これまで評価された方法の中で最も早く脊髄運動ニューロンマーカーが発現することを観察できた。さらに、家族性ALS患者から作ったiPS細胞由来の脊髄運動ニューロンでは、異常タンパク質の蓄積を認めたとしている。
これまでES細胞やiPS細胞から脊髄運動ニューロンを分化させる方法はいくつか報告されてきたが、化合物を用いる既存の方法では、多くの培養ステップを経る必要があった。研究チームが確立した技術はこの課題を改善し、脊髄運動ニューロンをきわめて簡便に作製することを可能にした。今後、ALSなどの脊髄運動ニューロンの病変を有する疾患の研究において有用な手段となることが期待されると、研究チームは述べている。
▼関連リンク
・京都大学iPS細胞研究所 ニュース




