Ca2+の動きに重要な役割果たすIP3Rの制御メカニズムは不明だった
理化学研究所は12月20日、細胞内カルシウムチャネルの制御因子「アービット(IRBIT)」が、小胞体からミトコンドリアへのカルシウムイオン(Ca2+)の流入量をコントロールすることで「アポトーシス」を制御することを発見したと発表した。この研究は、理研脳科学総合研究センター発生神経生物研究チームの御子柴克彦チームリーダー、ベンジャミン・ボノー基礎科学特別研究員らの共同研究チームによるもの。研究成果は「eLife」に掲載されるのに先立ち、オンライン版に12月20日付けで掲載されている。
画像はリリースより
アポトーシスはプログラムされた細胞死と呼ばれ、多細胞生物に見られる細胞の死に方のひとつ。不要になった細胞や損傷を受けた細胞が積極的に自滅することで、個体を健全な状態に保つために機能するメカニズムで、アポトーシスがうまく機能しないと、例えばDNAに損傷を受けてがん化した細胞が死なずに増殖してしまうなど、がんなどの疾患の原因になる。
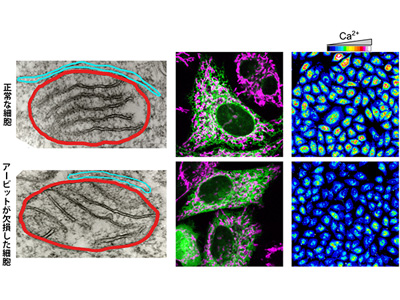
ストレス刺激などで細胞が損傷を受けると、エネルギー産生の場であるミトコンドリアへ過剰な量のCa2+が流入し、アポトーシスが誘導され、このミトコンドリアへのCa2+流入は、細胞内のCa2+貯蔵庫である小胞体とミトコンドリアが接する場所である「小胞体-ミトコンドリア接触部位」で起こる。このCa2+の動きには、小胞体の膜上にあるイノシトール三リン酸受容体(IP3R)というカルシウムチャネルが重要な役割を果たしているが、その制御メカニズムはよくわかっていなかった。
アポトーシスの機能不全よって引き起こされる疾患の分子機構の解明に期待
共同研究チームは、ゲノム編集技術を利用してアービットというタンパク質をコードする遺伝子を欠損したヒト細胞を作製・解析。その結果、アービット欠損細胞は、アポトーシスが起こりにくいことが明らかとなった。また、小胞体-ミトコンドリア接触部位の構造に異常が見られ、小胞体からミトコンドリアへのCa2+の動きが阻害されており、さらに「Bcl2l10」というタンパク質がIP3RのCa2+放出活性を阻害してアポトーシスを抑制すること、アービットがBcl2l10の抗アポトーシス作用を抑制することも明らかになったとしている。
これらの結果は、アービットが小胞体-ミトコンドリア接触部位の形成、あるいは安定化を促進し、IP3Rを介したCa2+の動きを制御することにより、アポトーシスが誘導されることを示すものとなる。
がん細胞は、しばしば抗がん剤によるアポトーシスに耐性を示し、ある種のアポトーシス耐性を示すがん細胞株では、アービットの発現が低下していることが報告されている。また、上皮性卵巣がん患者では、アービットの発現量が多いほど、予後がよいという報告もあるため、アービットの機能不全によりアポトーシスが正常に行われないことが、がんの発症あるいは増悪に関与している可能性がある。今後、アービットとBcl2l10による細胞内Ca2+動態の制御機構をさらに解析することは、アポトーシスの機能不全よって引き起こされる疾患の分子機構の解明へつながることが期待できると、共同研究チームは述べている。
▼関連リンク
・理化学研究所 プレスリリース




