大型放射光施設SPring-8など強力なX線を使用して構造解析
東京大学は10月20日、微生物の侵入を感知して免疫系を活性化するTLR7タンパク質の詳細な立体構造を世界で初めて明らかにしたと発表した。この研究は、同大学大学院薬学系研究科の清水敏之教授、張志寛大学院生、大戸梅治准教授、同大学医科学研究所の三宅健介教授、柴田琢磨助教、大阪大学大学院工学研究科の内山進准教授、首都大学東京理工学研究科の礒辺俊明教授、田岡万悟准教授らの研究グループによるもの。研究成果は「Immunity」10月号に掲載されている。
画像はリリースより
細菌やウイルスなどの病原体に対する感染防御機構として、自然免疫機構が備わっており、TLR受容体が主にその役割を担っている。TLR7は、TLR受容体のひとつで、ウイルス由来の一本鎖RNAまたは、合成低分子リガンドを感知することで、インターフェロンなどの産生を促すため、TLR7は、抗ウイルス薬、ワクチン、抗がん剤などのターゲットとして注目されていたが、リガンドを感知する具体的な機構は不明だった。
TLR7を標的とした治療薬開発につながる期待も
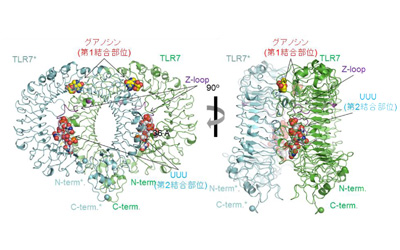
研究グループは、大型放射光施設SPring-8および高エネルギー加速器研究機構Photon Factoryの強力なX線を使用して構造解析した結果、TLR7が、一本鎖RNA(polyU)と2種類の低分子リガンド(グアノシン、loxoribine)のいずれか、あるいは低分子リガンドR848に結合した複合体の立体構造を明らかにした。その結果、TLR7はそれぞれのリガンドと2:2(または2:2:2)の複合体を形成することで、活性化型の2量体となることがわかった。
また、グアノシン、loxoribine、R848などの低分子リガンドは2量体の界面に位置する第1結合部位に、polyU一本鎖RNAはTLR7のリング型構造の凹面の第2結合部位に位置していた。構造解析と生化学的実験の結果、TLR7はこれらの2種類のリガンドによって協調的に活性化されることが明らかになったとしている。
今回の結果により、TLR7が、2つのリガンド結合部位を用いて2種類のリガンドを同時に認識し活性化することが明らかになった。今後は2つの作用点で制御するという新しい視点で、TLR7をターゲットとしたワクチンアジュバントやウイルス感染、アレルギーの治療薬などの開発につながることが期待されると、研究グループは述べている。
▼関連リンク
・東京大学 プレスリリース




