認知症やパーキンソニズムを呈する家族性の神経変性疾患
京都大学iPS細胞研究所(CiRA)は10月10日、前頭側頭葉変性症患者由来の疾患特異的iPS細胞とゲノム編集技術を用いることで、神経変性疾患のひとつである前頭側頭葉変性症(FTLD)の病態を細胞レベルで再現することに成功し、これまで不明であったFTLDのメカニズムの一端を明らかにしたと発表した。この研究は、CiRA増殖分化機構研究部門の今村恵子特定拠点助教および井上治久教授らの研究グループが、量子科学技術研究開発機構 放射線医学総合研究所の研究グループらとともに行ったもの。研究成果は、英国科学誌「Scientific Reports」に同日付けでオンライン公開されている。
画像はリリースより
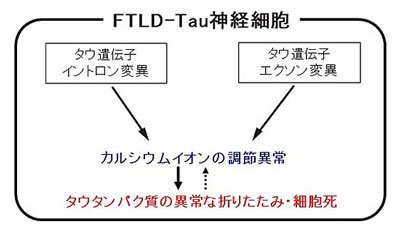
昨今、人々の寿命が延びる一方で、遅発性の神経変性疾患の患者は劇的に増えており、神経変性疾患の社会的負担は大きくなっている。神経変性疾患の多くは、タンパク質が異常に折りたたまれることによると報告されているが、そのひとつにFTLDがある。FTLDの一部は、タウタンパク質を作るタウ遺伝子の変異により発症する家族性疾患(FTLD-Tau)で、脳の前頭葉と側頭葉の神経が変性することにより萎縮し、認知症やパーキンソニズムを呈する。
FTLD-Tauを含む神経変性疾患の病態についてはこれまでiPS細胞を用いた研究が行われてきたが、FTLD-Tauのメカニズムは、詳細がまだ明らかになっていなかった。そこで、研究グループは、患者由来のiPS細胞から大脳皮質神経細胞へと分化させることで病態を再現するとともに、DREADDと呼ばれる人工的なデザイナー受容体を用いて、FTLD-Tauのメカニズムを検証した。
DREADDを患者由来iPS細胞に導入し、神経変性のメカニズムを解明
今回の研究では、2人の前頭側頭葉変性症患者から作製したiPS細胞、遺伝子変異を修復したiPS細胞と健常者から作製したiPS細胞(対照群)にNeurogenin2という転写因子を加えて大脳皮質神経細胞へと変化(分化)させた。
すると、患者由来細胞と対照群との間で、神経細胞への分化のしやすさや神経細胞を示す指標となるタンパク質の発現には差がなかったものの、患者由来神経細胞では異常に折りたたまれたタウタンパク質が蓄積していた。また、神経活動を人工的に調節できるDREADDというシステムを利用して、神経細胞間での情報伝達に重要な役割を果たすカルシウムイオンの細胞内への異常な流入が、異常に折りたたまれたタウタンパク質の蓄積や神経細胞の変性に関与するというメカニズムを明らかにしたという。
今後、このモデルを用いたさらなる病態の理解と、新薬の開発につながることが期待される。また、タウタンパク質はアルツハイマー病をはじめとするさまざまな神経変性疾患の病態に関与していることが知られており、それらの疾患の理解に向けた研究へも応用できると、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所 ニュース






