1年生存率は50%、3年生存率は10%のグリオブラストーマ患者
東京農工大学は9月28日、悪性脳腫瘍や遺伝性貧血にかかわるCHTOPタンパク質の細胞内濃度を調節しているメカニズムを明らかにしたと発表した。この研究は、同大学の泉川桂一助教と高橋信弘教授、首都大学東京の礒辺俊明特任教授らのグループによるもの。研究結果は、「Nucleic Acids Research」オンライン版に掲載された。
画像はリリースより
グリオブラストーマ(膠芽腫)は、腫瘍の中でも最も治療が難しい悪性の脳腫瘍。この腫瘍の治療法としては外科手術が一般的だが、手術によって腫瘍を全て摘出するのは困難なため、同時に放射線療法や化学療法が試みられる。しかし、その効果は弱く、グリオブラストーマ患者の1年生存率は50%、3年生存率は10%を少し超える程度と、非常に低いのが現状だ。
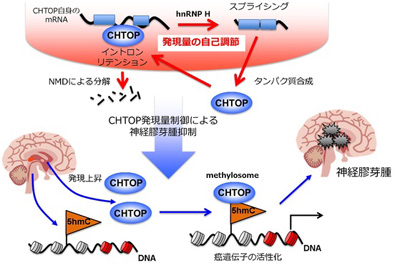
このような状況の中で、最近グリオブラストーマが腫瘍を形成するメカニズムが明らかになってきた。この腫瘍の幹細胞の染色体DNAでは、DNAを構成する塩基のひとつであるシトシンに5-ヒドロキシメチル化と呼ばれる化学修飾が高い頻度で起こっており、その結果生じる5-ヒドロキシメチルシトシン(5hmC)を目印としてCHTOP-メチロソーム複合体が集合し、その周辺のDNAに結合したヒストンをメチル化することで腫瘍形成に関わる遺伝子を活性化、グリオブラストーマの形成を促進する。したがって、もとの幹細胞DNAの5hmC修飾を阻害するか、CHTOP-メチロソーム複合体の働きを阻害することで腫瘍形成を抑制できると考えられる。
CHTOP発現を阻害する薬の開発に期待
今回、研究グループは、独自に開発を進めてきた日本発の最先端の質量分析法を利用して、CHTOPとRNAの結合で生じる複合体を解析することで、CHTOP-メチロソーム複合体の働きを抑える方法を発見した。すなわち、CHTOPは自分自身を合成する鋳型であるメッセンジャーRNA(mRNA)を形成する前段階のmRNA前駆体に結合することで、イントロンリテンションとナンセンス変異依存mRNA分解機構(NMD)で自分自身のmRNAを分解するという調節メカニズムで発現量を調節していることがわかった。
正常な細胞では、このメカニズムによって細胞内のCHTOPの量を一定に保っているが、グリオブラストーマでは、これが破綻してCHTOPの量が異常に増えることで腫瘍形成が促進されていると考えられる。したがって、CHTOPの発現量を調節するメカニズムについての今回の発見は、将来、CHTOPの発現を阻害する薬の開発によってグリオブラストーマの治療法の開発が期待されると、研究グループは述べている。
▼関連リンク
・東京農工大学 プレスリリース






