神経細胞で不均一な細胞質膨張が特徴の細胞死増加
東京医科歯科大学は9月7日、新しい細胞死TRIAD(Transcriptional Repression-Induced Atypical cell Death、転写抑制性非典型的細胞死)の細胞内シグナル経路の詳細を明らかにし、神経変性疾患のひとつであるハンチントン病の病態下でTRIADが生じていること、TRIADを標的とすることでハンチントン病の治療が可能であることを示したと発表した。この研究は、同大学難治疾患研究所神経病理学分野の岡澤均教授の研究グループによるもの。研究成果は「Human Molecular Genetics」オンライン版に9月13日付けで掲載されている。
画像はリリースより
一般に細胞死には、アポトーシス、ネクローシスという2つの細胞死があることが有名だが、近年になって、それ以外にオートファジー細胞死、ネクロプトーシス、TRIADなどの複数の細胞死が存在することが報告されている。
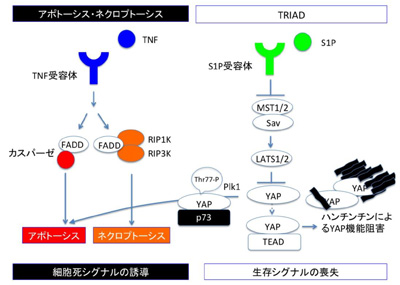
先行研究において研究グループは、DNAからRNAへの転写を司る中核分子であるRNA polymerase II をα-amanitinという特異的阻害剤を用いて抑制し、その際に生じる細胞死TRIADを発見し、疾患との関連性を示唆した。これに対し、今回はその逆方向、病気を起こす変異型のハンチントン病原因遺伝子であるハンチンチンを神経細胞に発現させて、どのような細胞死が誘導されるかを調査した。その結果、アポトーシスやネクローシスではなく、不均一な細胞質膨張を特徴とする細胞死が増加していることを発見した。
複数の変性疾患の治療法開発につながる可能性
さらに、変異型ハンチンチンによって誘導されるTRIADの細胞内シグナルの詳細を解析した結果、分裂細胞で活性の高いPlk1というキナーゼがYAPの77番目のスレオニン(Thr77)をリン酸化することで、YAPの相手をTEADからp73に変換する作用があることもわかった。また、核内のYAPを増やす方向に働く、S1PによるHippoシグナル経路の抑制が、ハンチントン病モデルマウスの神経細胞死と神経症状に治療効果を持つかを検討したところ、S1Pの髄液腔内投与は、R6/2マウスとKIマウスの両者で見られた小胞体のサイズ変動(不安定性)を明らかに改善した。
そして、KIマウスにおいては、発症後の投与でも、運動機能の改善が長期にわたり観察され、むしろ正常の老化マウスの運動機能に近づく傾向にあり、これらからTRIADのシグナル経路を標的とする治療法がハンチントン病態の治療に有効であると考えられるとしている。
今回の研究成果により、他の変性疾患におけるTRIADの関与を解明することなどを通じて、ハンチントン病をはじめとして複数の変性疾患の治療開発につながる可能性があると、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




