PARK17患者と同じ変異をVPS35遺伝子に持つマウス作製に成功
東京医科歯科大学は8月26日、家族性パーキンソン病PARK17のモデルマウスでは線条体内の神経終末からのドーパミン放出機能が障害されていることをつきとめたと発表した。この研究は、同大学脳統合機能研究センターの渡瀬啓准教授、同大学大学院医歯学総合研究科脳神経病態学分野の横田隆徳教授らの研究グループが、東京病院、千葉大学と共同で行ったもの。研究成果は、国際科学誌「Human Molecular Genetics」オンライン版に8月25日付けで掲載されている。
画像はリリースより
パーキンソン病の多くは家族歴のない孤発性パーキンソン病(sPD)だが、研究グループは、sPDと同様の症状を示す家族性(遺伝性)パーキンソン病のひとつ、PARK17に注目した。PARK17 はVPS35遺伝子の点変異(多くはD620N変異)が原因遺伝子であることがわかっている。VPS35は細胞質内においてさまざまなタンパク質のリサイクルを行う運び屋の役割を担っていて、神経細胞だけでなく、身体中の多くの細胞に存在しているタンパク質だが、なぜVPS35遺伝子の異常でパーキンソン病を発症するのかは不明だった。
研究グループは、CRISPR/Cas9システムという、自然界の細菌が免疫機能として持っているウイルスの侵入を防ぐ仕組みを応用したゲノム編集技術を用いてVPS35 D620N変異マウスおよびVPS35ノックアウトマウス(1塩基欠失:Del1)の作製に成功した。ヒトのVPS35タンパクは796個のアミノ酸から形成され、VPS35 D620N変異は620番目のアミノ酸がD(アスパラギン酸)からN(アスパラギン)に置換されたもの。このCRISPR/Cas9法で得られたVPS35変異マウスを交配し、得られたマウスの成長、行動分析をはじめ脳のタンパク分析、神経病理組織解析やドーパミン濃度の解析などを行った。
VPS35 D620N変異マウス、ドーパミン量が野生型マウスより少なく
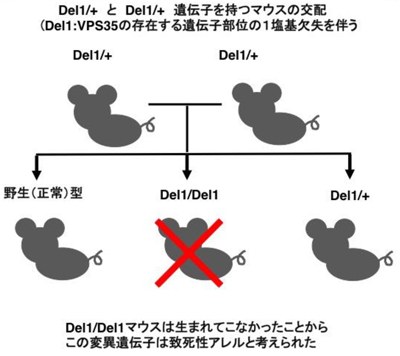
VPS35 D620N/D620N変異マウスについてはメンデルの遺伝の法則に従った数のマウス誕生が認められ、パーキンソン病のような運動機能障害は認められなかった。一方、VPS35 1塩基欠失型(Del1)アレルを2つ持っているVPS35 Del1/Del1マウスは誕生してこなかったことから、このDel1アレルは致死性アレルと考えられた。
さらにVPS35D620NマウスとDel1マウスの交配を行ったところ、D620N/Del1マウスが誕生したが、生後3週までの成長過程でそのうち約30%が死に至った。ヘテロ接合Del1/+マウスは正常に成長したことから、VPS35D620Nアレルは野生(正常)型アレル(+)とは異なり完全にはDel1アレルの致死性を補えず、部分的に機能を喪失していると考えられた。
次に研究グループは、中脳由来のドーパミン作動性神経の神経終末がシナプスを形成する線条体という組織にプローベという管を挿入し、マイクロダイアリシスという方法を用いて、シナプスから放出されるドーパミン濃度を経時的に測定。一般的にドーパミンを包んだシナプス小胞は電気刺激などを受けると、シナプス小胞とシナプス外膜が融合し、小胞内のドーパミンがシナプス末端から放出される。病理学的な解析などではVPS35 D620N変異マウスの線条体や黒質には明らかな神経変性は見られなかったが、マイクロダイアリシスの結果、VPS35 D620N変異マウスではKCl刺激によってシナプスから放出されるド-パミン量が野生(正常)型マウスと較べて少ないことがわかった。
これらの結果は、VPS35D620Nマウスのドーパミンの放出機能の低下はVPS35分子の部分的な機能喪失型変異によって生じている可能性が高いこと、ドーパミン産生神経細胞が少なくとも根茎のマウスの組織所見では明らかな神経変性を生じる前から始まっていることを示唆する所見であり、パーキンソン病の発症メカニズムを考えるうえで極めて重要な発見であると考えられると、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




