タンパク質MARCKSの上下のシグナル経路と病態意義明らかに
東京医科歯科大学は8月25日、アミロイド凝集前にリン酸化の異常変動を示すタンパク質MARCKSの上下のシグナル経路と病態意義を明らかにし、さらにMARCKSのリン酸化を誘導する細胞外分子HMGB1を標的とする抗体治療法を開発したと発表した。
画像はリリースより
この研究は、同大学難治疾患研究所および脳統合機能研究センター神経病理学分野の岡澤均教授の研究グループが、理化学研究所の宮脇敦史副センター長、西道隆臣チームリーダー、名古屋大学の祖父江元特任教授、創価大学の中嶋一行教授、MBLの梶川益紀博士らと共同で行ったもの。研究成果は「Scientific Reports」オンライン版に8月25日付けで掲載されている。
アルツハイマー病では、細胞外にアミロイドベータと呼ばれる異常タンパク質が沈着する老人斑と、細胞内にタウタンパク質が凝集する神経原線維変化の2つが起こることが知られている。15年ほど前からアミロイドベータに対する抗体医薬品の臨床試験が国際的な規模で行われてきたが、脳内のアミロイドベータ除去に成功したものの、患者の症状は改善が見られないことも予想外の知見として得られた。そのため、脳内にアミロイドベータ凝集が起きた後から治療を開始するのではすでに遅く、アミロイドベータの脳内での溜まり始めにアミロイド抗体療法を開始する、あるいは、脳内にアミロイドベータ凝集が起きる以前の超早期(Phase 0)に生じる脳内分子変化を解明して、新たな分子標的に対する治療を開発する必要があると考えられるようになってきた。
HMGB1抗体の実用化に向け、ヒト患者に使用可能な製剤化を
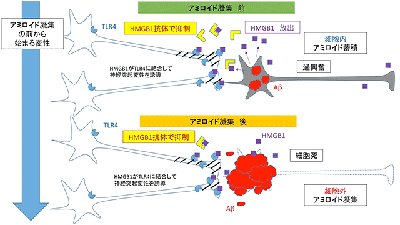
研究グループは、先行研究でアミロイド凝集前にリン酸化の異常変動を示すタンパク質MARCKSを同定したが、今回、MARCKSタンパク質中の多数のリン酸化部位のどの場所がアルツハイマー病態に重要なのかを、アルツハイマー病モデルマウスでの変動開始時期、アルツハイマー病ヒト死後脳での結果との比較、候補部位に対するリン酸化抗体による形態学的解析、などから絞り込みを行った。その結果、Ser46部位のリン酸化が超早期(アミロイド凝集前)から上昇すること、Ser46部位でリン酸化したMARCKSタンパク質(pSer46-MARCKS)に対する抗体が脳内アミロイド斑周囲に集まる変性神経突起を染色することを認めたとしている。
また、DAMPs(damage-associated molecular patterns)はTLR(Toll-like receptor)やRAGE(receptor for advanced glycation end products)と呼ばれる膜タンパク質と結合して、細胞障害性のシグナルを誘導することが知られている。そこで、細胞生存に必須なタンパク質であるHMGB1(High mobility group box1)とアミロイドベータのpSer46-MARCKS誘導効果を調べると、HMGB1にその作用があることがわかり、アルツハイマー病ヒト患者の髄液を調べると、進行の早い一部の患者でHMGB1が高い傾向にあることが示唆され、pSer46-MARCKSの増加がヒトADにおいても同様な病態意義を持つことを支持する結果になった。さらに、細胞外からのHMGB1刺激を抑制するためにHMGB1抗体を作成して、アルツハイマー病モデルマウスを用いて治療効果を調べた結果、HMGB1抗体は脳内のpSer46-MARCKS増加を抑えること、シナプス後部構造スパインの減少を回復させること、そして認知機能障害を改善することが示されたとしている。
今回、MARCKS、TLR4、HMGB1などの分子が担う、アルツハイマー病超早期病態の一端が明らかとなり、細胞外HMGB1を標的とする新規抗体治療法を開発したことにより、アルツハイマー病治療に直接役立つ可能性がある。この研究成果を手掛かりに、さらに超早期病態の全容解明を進めることによって、新たな治療標的分子あるいは新たな治療標的メカニズムが得られることが期待される。今後、HMGB1抗体の実用化に向けてヒト患者に使用可能な製剤化を行い、さらに臨床試験を行うことを目指すと、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース






