移植アッセイ法を用い、ノックアウトマウスの精子幹細胞の状態を解析
京都大学は8月10日、精子幹細胞の自己複製を促す新しい遺伝子「WNT5A」を発見したと発表した。研究結果は、同大学大学院医学研究科の篠原隆司教授、篠原美都助教らの研究グループによるもの。研究成果は、米国科学誌「Stem Cell Reports」誌に8月9日付けで掲載された。
画像はリリースより
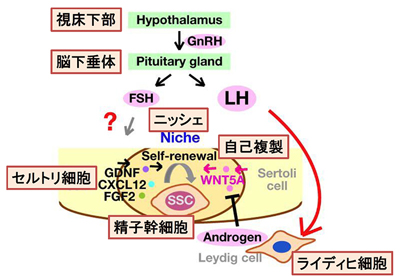
精子幹細胞は自己複製と分化を繰り返し、個体の生涯にわたり精子を作り続けるといわれている。脳下垂体から分泌される2つの性腺刺激ホルモンである、卵胞刺激ホルモン(Follicle Stimulating Hormone:FSH)と黄体形成ホルモン(Luteinizing Hormone:LH)のうち、これまではFSHが精子幹細胞の自己複製を促進すると考えられていた。
しかし、研究グループは、この定説とは異なった見解を持っていたとしている。なぜなら、精子幹細胞は精巣細胞のうち0.02~0.03%の割合でしか存在せず、その解析は非常に困難。精子幹細胞は特別な微小環境において自己複製を行うと考えられているが、その数は非常に少なく、同定することは不可能であるからだ。そこで、今回の研究では、精子幹細胞を直接同定できる移植アッセイ法を用い、これらのノックアウトマウスにおける精子幹細胞の状態を解析した。
男性不妊の原因の理解やその治療法の開発に期待
下垂体ホルモンFSHおよびLHが精子幹細胞の自己複製に及ぼす影響を解析するため、研究ではFSHおよびLH受容体の欠損モデルマウスを用いた。また精子幹細胞機能を調べる上で唯一の機能的アッセイである精子幹細胞移植法により、精子幹細胞機能を定量的に評価。まず、FSHまたはLH受容体欠損マウスがもつ精巣細胞をそれぞれ移植のドナーとして、野生型精巣をホストとする移植実験を行い、それぞれのモデルマウスの精子幹細胞機能を調べた。するとFSHノックアウトマウスには特に異常が見られなかったが、LH受容体欠損マウスでは幹細胞の濃度が上昇した。
次に、精子幹細胞制御を担うニッシェの状態を調べるために、FSHおよびLH受容体の欠損マウス精巣をホストとし、これらのマウスに野生型精巣細胞をドナーとする移植実験を行った。この実験でも、FSH欠損マウスの精子幹細胞ニッシェ機能は正常であることが示された。これに対して、LH受容体欠損マウス精巣内では精子幹細胞の移植効率が良くなり、さらに精巣内で精子幹細胞増殖能も高くなる結果が得られた。つまり、LH受容体の欠損により精子幹細胞ニッシェ機能が亢進することが示された。したがって、FSHはニッシェ機能には関与せず、LHは精子幹細胞ニッシェ機能を負に制御するということが明らかになった。
そこでLH受容体欠損マウスの精巣細胞を回収し、その遺伝子解析を行うことでどのようにして幹細胞の自己複製が促進されているかを調べた。LH欠損マウス精巣で発現が変化している遺伝子をマイクロアレイ解析により網羅的に探索した結果、486遺伝子の発現が変化していることを見出した。これらの中でLH欠損により発現が上昇し、また分泌因子である4遺伝子を候補遺伝子として、さらに精子幹細胞の自己複製を促進させるかどうかを調べたところ、WNT5Aという遺伝子は試験管内で精子幹細胞の自己複製を促すことを発見。さらにWNT5Aを精巣内に導入しても精子幹細胞の自己複製能が高くなることが示された。したがって、LHシグナルの欠損によりWNT5Aの発現が上昇することで精子幹細胞ニッシェ機能が促進される仕組みが明らかになったとしている。
この研究成果は男性不妊の原因の理解やその治療法の開発に役立つとともに、遺伝病の発症機序の理解にも貢献すると期待されると、研究グループは述べている。
▼関連リンク
・京都大学 研究成果




