臨床上問題の過凝固示す臨床検査値の異常認められず
中外製薬株式会社は7月28日、血友病Aを予定適応症として皮下投与により開発中のバイスペシフィック抗体emicizumab(ACE910)に関し、米国オーランドで開催中の世界血友病連盟2016年世界大会(World Federation of Hemophilia 2016 World Congress:WFH2016)において、継続中の国内第1/2相臨床試験(ACE002JP)の最新データを公表したと発表した。
画像はリリースより
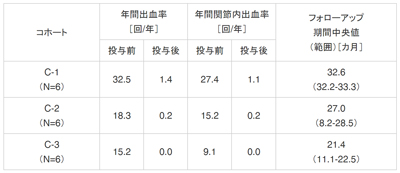
ACE002JP試験は、血液凝固第8因子に対するインヒビター保有/非保有の日本人の血友病A患者を対象に、emicizumabの安全性および出血抑制を目的とした予防投与の有効性について、探索的な検討を行った第1相臨床試験(ACE001JP試験)の患者パートの継続投与試験。最新データの解析の結果、emicizumabの週1回の皮下投与によりインヒビターの有無にかかわらず、良好な有効性が引き続き確認された。フォローアップ期間中央値は、0.3、1、3mg/kgの各投与群において、それぞれ32.6か月、27.0か月、21.4か月だった。
安全性については、18例全例に有害事象が認められたが、虫垂炎、腸間膜血腫の2件の重度の有害事象を除き、いずれも軽度、中等度の事象だった。臨床上問題となる過凝固を示唆する臨床検査値の異常や臨床所見は認められなかった。
2016年にインヒビター非保有患者の第3相国際共同治験を開始予定
Emicizumabは、FDAより2015年9月に画期的治療薬に指定されており、戦略的アライアンスを締結しているロシュ社と共同で血友病Aを対象として開発中。現在、青年/成人および小児のインヒビター保有患者を対象とする第3相国際共同治験をそれぞれ実施中で、今年中にインヒビター非保有患者を対象とする第3相国際共同治験および4週1回投与の第3相国際共同治験も開始する予定。
今回発表された長期フォローアップデータは、インヒビターの有無にかかわらず、emicizumabの出血抑制効果が継続して発揮されることを裏付けるもの。同剤が血友病Aの治療に革新をもたらし、患者や家族にこれまでにない選択肢を提供することが期待されると、中外製薬は述べている。
▼関連リンク
・中外製薬株式会社 ニュースリリース






