AMPA受容体の異常、運動ニューロン死の原因
東京大学は6月28日、筋萎縮性側索硬化症(ALS)の発症原因に根ざした新規治療法の開発に成功したと発表した。この研究は、国際医療福祉大学臨床医学研究センター特任教授で、東京大学大学院医学系研究科講師の郭伸氏らの研究グループによるもの。同成果は、「Scientific Reports」オンライン版に同日付けで掲載されている。
画像はリリースより
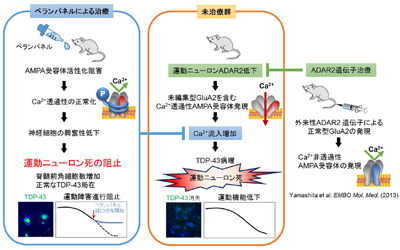
研究グループはこれまで、ALSでは神経伝達に関わるグルタミン酸受容体の一種であるAMPA受容体の異常が運動ニューロン死の原因であることを突き止めていた。具体的には、AMPA受容体のカルシウム透過性を規定するサブユニットであるGluA2に本来生ずべきRNA編集(転写後の一塩基置換)が起こらず、未編集型GluA2が発現するためカルシウム透過性が異常に高いAMPA受容体が運動ニューロンに発現していること、加えて、GluA2が未編集となるのはRNA編集酵素であるADAR2酵素の発現低下のためであることを確かめていた。さらに、ADAR2のコンディショナルノックアウトマウス(AR2マウス)の解析から、ADAR2酵素の発現低下は、異常なカルシウム透過性AMPA受容体の発現を引き起こすことにより運動ニューロン死の直接の原因であることを証明し、孤発性ALSの運動ニューロンで起きるTDP-43の局在異常(TDP-43病理)を引き起こすことからも、この分子異常が孤発性ALSに病因的意義を持つことを示してきた。
一方、高選択非競合AMPA受容体拮抗剤であるペランパネル(製品名:フィコンパ)は、グルタミン酸によるシナプス後AMPA受容体の活性化を阻害し、神経の過興奮を抑制することで運動ニューロン死を抑制すると考えられる。
孤発性ALSの特異的治療法として早期実現へ
研究グループが開発した孤発性AR2マウスでは、ALSに特有な運動機能障害、選択的な運動ニューロン死、ALSに特異的なTDP-43病理が観察されることから、孤発性ALSの病態を反映するモデル動物であると考えられる。そこで、このマウスに、臨床的に用いられている薬用量相当のペランパネルを経口的に投与し効果を検討したところ、脊髄の運動ニューロンの減少が有意に抑制され、進行性の運動機能低下が抑えられた。また、ALSに特有なTDP-43タンパクの細胞内の異常な局在変化を改善。これらはペランパネル投与により、AMPA受容体での異常なカルシウム透過性が改善され、神経細胞の過興奮が抑えられた結果、運動ニューロン死が阻止されたと考えられる。
この効果は症状が進行した時期のマウスにおいても確認されており、全てのマウスが90日間の経口投与を完了できたという安全性の面からも、孤発性ALS患者に対しての治療効果が得られる可能性があることを示唆するとしている。
ペランパネルはすでに承認されているてんかん治療薬であり、ヒトに換算した場合にてんかん治療に要する用量以下でマウスに有効性が確認できたことから、臨床応用へのハードルも低いと考えられ、ALSの特異的治療法になるものと期待されると、研究グループは述べている。
▼関連リンク
・東京大学 プレスリリース




