視床と大脳皮質のシナプスのSTDP変化に着目
大阪大学は6月30日、長年不明であった大脳皮質内の神経回路形成の重要なメカニズムを解明したと発表した。大麻(マリファナ)の有効成分でもあるカンナビノイドが、大脳皮質神経回路の破綻をきたすことがわかったとしている。これは、同大学大学院医学系研究科解剖学講座(分子神経科学)の木村文隆准教授を中心とする研究グループによるもの。研究成果は、米国科学誌「Journal of Neuroscience」オンライン版に6月29日付で掲載された。
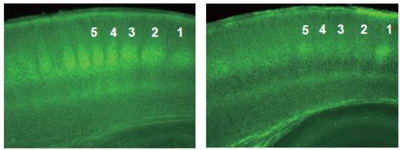
画像はリリースより
これまで、神経回路の形成や精緻化にはシナプス前後の神経の活動が大きな影響を及ぼすことが知られていたが、具体的にシナプス前後のどのような活動がどのようにして形態的変化をもたらすのかはわかっていなかった。特に、視床から大脳皮質への投射の形成ではより複雑で、未熟な大脳皮質に一旦広く投射ができた後、大脳皮質の成長に伴って、不要な投射が削られ、正しい投射先だけが残っていくというように2段階に進むが、そのメカニズムは不明だった。
大脳皮質の他の部位(4層-2/3層間シナプス)では、シナプス前後の細胞の発火順序に依存してシナプスの強度がきまるルール(スパイクタイミング依存性可塑性:STDP)が働くことが知られていたが、研究グループでは、このシナプス(4層-2/3層間シナプス)でも回路ができている最中にはSTDPのルールが異なっており、成長のある段階でルールが急に変化することを見つけていた。今回、視床と大脳皮質のシナプスでも投射形成に伴って同様にSTDPの変化がある可能性に着目し、検討を行ったとしている。
大脳損傷、認知症の治療薬につながる可能性
研究グループは、視床―皮質投射ができる時、最初はシナプス前後(視床細胞と大脳皮質細胞)の同期した活動によってシナプスが強化され、広い範囲に投射が伸びた後一部の投射先を除いて今度は同期した活動がシナプスを弱化されるというルールに変化し、余計な投射が刈り込まれ整然とした投射ができることを見出した。
また、このシナプス弱化時には同期した活動によって神経細胞からカンナビノイドが放出されること、さらに、放出されたカンナビノイドによって不要な神経投射が退縮することがわかった。同時に、カンナビノイドを外来性に摂取しても神経投射が退縮することも確認された。さらに、カンナビノイドの受け手であるカンナビノイド受容体の機能を遺伝的に欠如させると余計な投射の刈り込みがなくなり、無秩序な投射のまま残ってしまうことが判明したとしている。
今回の研究成果により、神経回路形成のメカニズムの理解がさらに進むこと、脳損傷や認知症の治療薬につながる可能性も考えられるとしている。大麻摂取が脳の正常な発達に障害を与えることを科学的に証明したことから、大麻や危険ドラッグの乱用減少への啓発にも貢献が期待されると、研究グループは述べている。
▼関連リンク
・大阪大学 研究情報




