非がん性慢性疼痛治療でオピオイド鎮痛薬長期服用のOCI患者対象に
塩野義製薬株式会社は5月24日、末梢性μオピオイド受容体拮抗薬「ナルデメジン」(一般名)の第3相臨床試験であるCOMPOSE IおよびCOMPOSE IIの良好な試験結果を、米国サンディエゴで開催中の米国消化器病週間(DDW2016)で公表したと発表した。
画像はリリースより
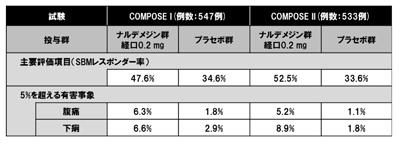
COMPOSE IおよびCOMPOSE IIは、非がん性慢性疼痛の治療のためにオピオイド鎮痛薬の服用中でオピオイド誘発性の便秘症(OIC)を呈している患者を対象に、ナルデメジン(経口剤0.2mg1日1回)の有効性ならびに安全性を確認した第3相臨床試験。非がん性慢性疼痛の治療のためにオピオイド鎮痛薬を長期に(3か月間以上、試験開始前4週間は同一の用量で)服用し、OICを呈している患者それぞれ547人、533人を対象としている。ナルデメジンのOICに対する治療効果と安全性をプラセボとの比較により評価することを目的に、多施設共同、プラセボ対照、無作為、並行群間二重盲検比較法によって行われた。
SBMレスポンダー率、有意に改善
同社によると、主要評価項目であるSBMレスポンダー率は、プラセボ群に比較して有意な改善が認められた。SBMは、レスキュー緩下薬使用後24時間以内の排便を除く排便、自然排便の意で、SBMレスポンダー率は「1週間のSBM回数が3回以上かつSBM回数のベースラインからの変化量が1以上」を満たした週が治療期12週間のうち9週間以上、かつ最終4週間のうち3週間以上ある被験者の割合。また、ナルデメジンは両試験で、設定したすべての副次的評価項目も達成した。ナルデメジン投与による鎮痛効果への影響は認められず、5%を超える有害事象は腹痛と下痢のみだった。
オピオイド鎮痛薬を慢性的に服用している患者の40~50%に発症すると言われているOICに対して、既存の治療薬の有効性への満足度は低く、また副作用など安全性への課題から、オピオイド鎮痛薬による疼痛管理を困難にするケースがある。今回の試験により認められたナルデメジンの高い有効性と優れた安全性は、ナルデメジンがOICの新たな治療選択肢となり、副作用緩和の面からオピオイド鎮痛薬による疼痛コントロールに大きく貢献することを示唆する、と同社は見ている。
なお、同社はこの試験結果などをもとに、今年3月にナルデメジンの日本における製造販売承認申請、米国での新薬承認申請を提出している。
▼関連リンク
・塩野義製薬株式会社 プレスリリース




