生きた神経細胞内や生体内でAβタンパク質の動態を可視化
産業技術総合研究所は3月16日、アルツハイマー病の原因因子の1つであるアミロイドβ(Aβ)タンパク質の動態を、生きた神経細胞内や生体内で可視化する技術を開発したと発表した。この研究は、同研究所バイオメディカル研究部門脳遺伝子研究グループの落石知世主任研究員、北海道大学大学院先端生命科学研究院の北村朗助教、順天堂大学医学部脳神経内科の志村秀樹准教授らの共同研究グループが行ったもの。
画像はリリースより
認知症患者の増加は、医療費や介護制度の現状などが絡み合い、世界的にも大きな社会問題となっている。特に記憶障害や判断能力の低下、見当識障害などを特徴とするアルツハイマー病は、認知症の半数以上を占める。Aβを主成分とする老人斑の神経細胞周囲への沈着と過剰にリン酸化されたタウタンパク質が神経細胞内に蓄積する神経原繊維変化、脳の萎縮が発症原因として有力であるものの、いまだアルツハイマー病発症のメカニズムは解明できていない。
最近になり、少数のAβ分子が重合したAβオリゴマーが細胞に対する強い毒性を有し、これが細胞内に蓄積されることが病気の発症に強く関与するという説が有力になりつつある。しかし従来の方法では、細胞や脳組織の標本を用いた解析しかできなかったため、生きた細胞内でAβのオリゴマー化の状態を直接可視化して毒性との因果関係を詳細に解析する方法や、治療薬の候補となる物質のAβの重合に対する効果を直接解析する新たな手法が求められていた。
発症メカニズムの解明、治療薬物質候補のスクリーニング貢献に期待
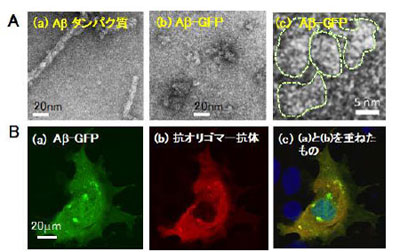
今回研究グループは、Aβと蛍光タンパク質「GFP」(Green Fluorescent Protein)を繋ぐリンカーとして、14個のアミノ酸を用いて、Aβ分子の重合体が形成されても蛍光を観察できる、Aβ-GFP融合タンパク質「Aβ-GFP」を開発。このAβ-GFPを核磁気共鳴装置や電子顕微鏡、免疫組織化学法、蛍光相関分光法で解析したところ、GFPを融合させたことでAβの重合が一定以上進まず、生体内でも生体外でも2量体から4量体を中心としたオリゴマーの状態で存在することがわかったという。この特徴により、生きた細胞内でAβのダイナミックな動きや、初代培養神経細胞内での蓄積状態などの解析が可能になった。また、重合が進んで繊維状となったAβよりも、オリゴマーのほうがより強い毒性を有することから、Aβオリゴマーの重合の度合いと細胞への毒性との関係などの解析を行うことも可能となったとしている。
さらにAβとGFPを繋ぐリンカーが短いと、重合の影響を受けてGFPの蛍光は観察されなくなるという現象を利用。重合の状態が検出できるシステムを考案し、GFPの蛍光強度を利用した治療薬候補物質のスクリーニングが可能であることを実証した。GFP単独を特定の神経細胞に発現させたトランスジェニック線虫では、神経細胞内に明瞭な蛍光が観察できるが、2個のアミノ酸からなる短いリンカーを持つAβ-GFPを発現させた線虫では、Aβの重合の影響を受けてGFPの蛍光は観察されなかったという。この線虫を、Aβの重合を抑制するクルクミンを加えた培地で飼育した結果、GFPの蛍光が観察でき、Aβ-GFPは蛍光強度の変化を測定することで、Aβの重合を抑える創薬候補物質のスクリーニングに利用できることが明らかとなった。
研究グループは今後、培養神経細胞を用いて、Aβ-GFPの蛍光強度を利用したアルツハイマー病の治療薬や予防薬の候補となる物質をより簡便にスクリーニングできる方法の開発に着手する予定。また、今回開発したAβ-GFPを発現させたトランスジェニックマウスを用いて、アルツハイマー病発症のごく初期に起こる神経細胞内部での微細な変化にAβオリゴマーが与える影響についてより詳細な解析を行い、アルツハイマー病発症のメカニズムの解明や予防に関する研究を進めていくとしている。
▼関連リンク
・産業技術総合研究所 プレスリリース




