マウスに腫瘍生着させ、薬がどのようにがん細胞に到達するかを観察
東京大学は2月16日、がんに対するDDS(薬物標的治療)の効率を高める新しい腫瘍血管透過経路について研究結果を発表した。この研究は、同大学医学部附属病院耳鼻咽喉科・聴覚音声外科の松本有助教授、同大学大学院工学系研究・医学系研究科の片岡一則教授らの研究グループによるもの。研究成果は、「Nature Nanotechnology」オンライン版に、英国時間の2月15日付けで発表された。
画像はリリースより
これまで多くのDDS製剤は、腫瘍血管の細胞間隙やフェネストラと呼ばれる細胞内小孔などの透過性の高い穴を介して徐々に高分子物質が血管外へ漏出するEPR効果により抗腫瘍効果を発揮していた。しかし、膵がんやスキルス胃がんなどの難治がんに対しては、特徴的な厚い間質形成などの理由から、多くのDDS製剤が理想的な治療効果を得られないのが実情だった。粒子径の大きいDDSはこの間質を突破できず血管近傍に留まることが判っており、片岡教授らの研究チームはこれまでに、粒径を小さくすることにより間質を突破出来ることを示してきたという。
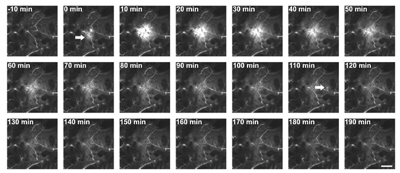
研究では、生きたマウスに腫瘍を生着させ、蛍光性の分子を結合させて標識した高分子ナノミセルの腫瘍内分布を観察することにより、薬がどのようにがん細胞に到達するのかを調べた。高分子ナノミセルの腫瘍内分布について、短い撮影間隔かつ長時間、詳細に観察。マウスの麻酔管理や撮影技術が向上したこと、また、高い血中滞留性を持つ高分子ナノミセルを開発したことにより、DDSの腫瘍内分布様式の動的な情報が得られるようになった。
eruptionメカニズム解明で、新しい治療法開発につながる可能性も
研究グループは、腫瘍血管が不規則に開閉し、そこから蛍光標識した高分子ナノミセルが血管外組織へ漏出するという、極めて動的な現象を発見。噴出はおおむね60分以内に収束するダイナミックな現象であるため、従来の組織片を連続的に薄くスライスした固定薄切を伴う組織学的手法では捉えることが不可能だった。
粒径の異なる高分子ナノミセルを投与し、画像解析やコンピューターシミュレーションを行った結果、噴出の発生頻度は腫瘍細胞からの距離と相関すること、噴出速度は腫瘍血管内外の圧力を駆動力とすること、噴出後の拡散は間質密度に左右されることなどが判明したとしている。
この研究は、「静的な穴(static pore)」とは別に、短時間だけ開閉する「動的な隙間(dynamicvent)」からの「噴出(eruption)」を新たに提唱するもの。今後の研究によってeruptionのメカニズムを解明し、これを誘発あるいは抑制することができれば、難治性腫がんに対する新しい治療法の開発につながるものと期待されると研究グループは述べている。
▼関連リンク
・東京大学 プレスリリース






