最も甘いモネリンY65R変異体と同等の強い甘味
京都大学は2月4日、同大学大学院農学研究科の桝田哲哉助教、イタリアのフェデリコ2世ナポリ大学のP.A. Temussi教授らのグループが、甘味タンパク質ソーマチンの21位のアスパラギン酸(D)をアスパラギン(N)に置換することにより、甘味度を強化(高甘味度化)することに成功したと発表した。このソーマチンD21N変異体は、最も甘いタンパク質であるモネリンY65R変異体と同等の強い甘味を示したとしている。研究成果は、英国科学誌「Scientific Reports」誌の電子版に2月3日付けで掲載された。
画像はリリースより
研究の背景として、近年、肥満をはじめとする生活習慣病が社会問題となっており、多くの低カロリー甘味料が食品、飲料に使用されている。タンパク質は一般的に無味だが、例外的に強い甘味を呈するタンパク質が存在。甘味タンパク質の特徴を見出すことにより、甘味タンパク質を糖代替物としての利用、さらには甘味受容機構の解明を目論み、多くの研究がなされてきた。
研究グループはこれまで、甘味タンパク質のひとつであるソーマチンを研究対象として、甘味発現に関わるアミノ酸残基の同定、大型放射光施設(SPring-8)において高分解能X線結晶構造解析を行い、甘味タンパク質の構造と機能の相関について研究してきた。しかし、ソーマチンの甘味度をさらに強化することは長らく困難だったとしている。
より受諾性のある新規低カロリー甘味料の創製に期待
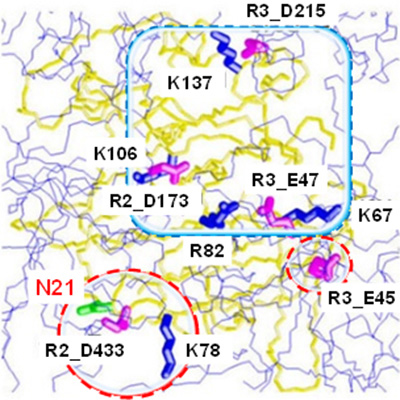
研究グループによると、これまでにソーマチンの甘味にはアルギニンやリジンなどの塩基性アミノ酸残基、その中でも82位のアルギニン残基と67位のリジン残基が特に甘味に重要な役割をしていることが明らかになっている。
そこで、今回はSPring-8で構造決定したソーマチンの高分解能立体構造情報を用いて、アルギニン82とリジン67が位置しているタンパク質表面に存在する酸性アミノ酸残基(アスパラギン酸、グルタミン酸)に着目。部位特異的変異法により酸性アミノ酸残基を他のアミノ酸に置換したところ、多くの酸性アミノ酸残基は甘味には関与しなかったものの、21位のアスパラギン酸をアスパラギンに置換すると甘味度が強化することがわかった。
この新たな知見から、甘味受容体と精度の高いドッキングシミュレーションを行うことができた。その結果、甘味タンパク質ソーマチンは低分子甘味料とは異なる様式(Wedge model)で甘味受容体と相互作用すること、ソーマチンの甘味に重要なアミノ酸残基は、受容体上のアミノ酸残基と電荷相補的な相互作用をすること、今回のアミノ酸置換による高甘味度化は受容体との相互作用領域が大きくなった結果である可能性を示唆したとしている。
研究成果による受容体タンパク質との相互作用情報により、より受諾性のある新規低カロリー甘味料の創製をはじめ、甘味タンパク質を新たな食品素材としてさらなる有効利用が期待できる。また、高分子タンパク質と受容体とのドッキングモデルは、受容体をターゲットとする医薬品分野にも有用な知見を与えるものと、研究グループは述べている。
▼関連リンク
・京都大学 研究成果




