ALSの病巣にある異常凝集物の主成分「TDP-43」に注目
京都大学は1月12日、同大学医学研究科の漆谷真准教授、和歌山県立医科大学の伊東秀文教授らの共同研究グループが、神経難病である筋萎縮性側索硬化症(ALS)の原因蛋白質の異常構造を特異的に認識して分解する仕組みと、その破綻がオリゴデンドロサイトというグリア細胞の病的封入体形成に関与している可能性を見出したと発表した。研究成果は、英科学誌「Scientific Reports」誌に1月11日付けで掲載されている。
画像はリリースより
ALSは、随意運動を司る神経がほぼ選択的に死滅し、全身の筋肉の萎縮と筋力低下を進行性にきたす最も重篤な神経難病のひとつ。病態は未だに不明で、根治的な治療法も存在しない。しかし、以前からALSの病巣に異常凝集物が蓄積する現象は知られており、近年TDP-43という蛋白質が主な成分と判明したことから治療標的として注目を浴びている。
病態解明や分子標的治療の可能性を開く
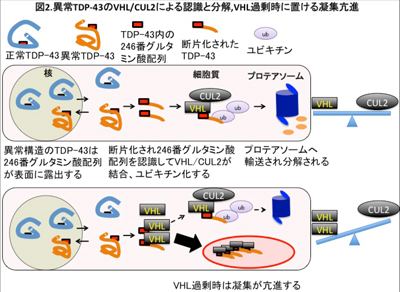
共同研究グループは、標識したTDP-43蛋白質をユビキチン・プロテアソーム系に必要な分子を含む細胞破砕液と混ぜてユビキチン化反応を起こし、Reversible covalent linked immunoprecipitation(ReCLIP)法という方法でユビキチン化の過程でTDP-43と架橋剤で結合させられた蛋白質を回収し、結合を解離させた後に質量解析を行い、アミノ酸配列を同定した。同定された分子が病的なTDP-43のユビキチン化や分解、さらにALSの病態とどのように関連するかについて、培養細胞の遺伝子導入実験や独自の抗体を用いたALS患者組織の組織化学解析を行った。
その結果、がん関連蛋白質von Hippel Lindau(VHL)とCullin2(CUL2)からなるユビキチンリガーゼ複合体が、ALSで出現する病的なTDP-43と結合し、ユビキチン化とプロテアソームでの分解を促進することを発見した。さらに、その仕組みの破綻が神経細胞周囲のグリア細胞であるオリゴデンドロサイトにおける病的封入体形成に関与していることを明らかにしたという。
オリゴデンドロサイトの機能異常は近年ALS病態の重要な要素として注目されており、研究成果は、ALS病態の解明と治療開発への道を開くものと期待される。
▼関連リンク
・京都大学 研究成果




