既存の治療薬に抵抗性または不耐容の患者向け
大塚製薬株式会社は1月8日、米国のアリアド・ファーマシューティカルズ・インクが開発した既存のチロシンキナーゼ阻害薬(TKI)に抵抗性または不耐容の慢性骨髄性白血病(CML)とフィラデルフィア染色体(Ph)陽性急性リンパ性白血病(Ph+ALL)の治療薬である「ポナチニブ」(海外製品名:Iclusig(R)、アイクルシグ)について、日本国内での製造販売承認申請を行ったことを発表した。
画像はリリースより
日本では、CMLは10万人に1人程度の割合ですべての年齢層で発症。患者数は約1万1,000人と推定されている。TKI治療の進歩により死亡率は低下しているが、高齢者の人口増加に伴い罹患者数は増加傾向にある。CMLは、病気発症時からの慢性期(5~6年間)では初期症状はほとんど見られないが、白血球数、芽球の比率が高くなり、病気の進行とともに全身倦怠感、体重減少、肝脾腫による腹部膨満感に始まり、移行期(6~9か月間)になると骨痛、肝脾腫の増悪、さらには急性転化期(3~6か月間)になると貧血、出血傾向、感染へと症状が段階的に増悪していき、治療抵抗性となる。
一方、Ph+ALLは小児および高齢者に見られ、初期治療後に再発する、あるいは治療抵抗性の患者の予後は極めて不良であるため、未だ解決すべき課題となっている。
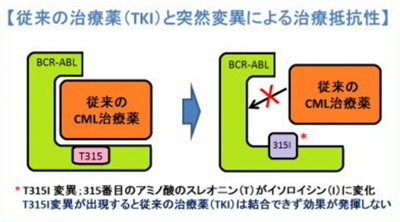
CMLやPh+ALLの治療薬には、第一選択薬としてTKIが使用されるが、病気が進行してくると病因であるBCR-ABL遺伝子の増幅や過剰発現、遺伝子の突然変異など様々な原因によりTKI治療の抵抗性を示すようになり、既存のTKIを使用しても十分な治療効果が得られない場合がある。また、既存のTKIによる副作用によりTKIの治療を継続できない不耐容の患者もいる。これら治療抵抗性や不耐容の患者においては、新しいTKIが日本やアジア地域で望まれているという。
2015年9月オーファンドラッグ指定
「ポナチニブ」は、アリアド社が創製したCMLやPh+ALLに発現するBCR-ABLに作用するTKI。同剤は、新規に化学合成された経口TKIであり、野生型BCR-ABLおよび他のTKIに抵抗性を示す変異型BCR-ABLであるT315I変異などに対して阻害作用を示すように設計されている。そのため、既存のTKIに抵抗性または不耐容のCML、再発または難治性のPh+ALL、特にT315I変異に代表される変異型BCR-ABLにも効果を示す。2012年12月に米国FDAで承認され、2013年7月に欧州でも承認を取得した。
国内では、アリアド社が有効性と安全性、忍容性についてフェーズ1/2試験を多施設共同試験として実施。大塚製薬は、この試験結果と海外の試験結果を併せて申請したという。なお、日本では2015年9月に「オーファンドラッグ」としての指定を受けている。
▼関連リンク
・大塚製薬株式会社 ニュースリリース






