CBP遺伝子、p300遺伝子と相互に補い合い機能する関係
国立がん研究センターは、肺がんの中でも悪性度が高い肺小細胞がんや悪性リンパ腫など様々ながんで不活性化変異がみられる「CBP遺伝子」について、「p300遺伝子」と相互に補い合い機能する関係があり、両方の遺伝子が機能しなくなるとがん細胞が死滅する「合成致死」の関係にあることを発見し、そのメカニズムを解明したことを発表した。
画像はリリースより
この研究は、国がん研究所ゲノム生物学研究分野と、同研究所と包括的研究提携契約を締結している第一三共株式会社との共同研究よるもの。研究成果は、米国がん学会科学雑誌「Cancer Discovery」で発表された。
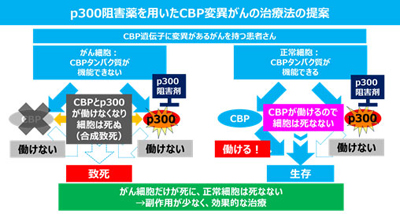
国がんによると、がんで見つかる遺伝子の変異には、肺がんに見られるEGFR遺伝子やALK遺伝子などのように活性化をもたらすタイプと、遺伝性の乳がんや卵巣がんに見られるBRCA1、BRCA2遺伝子や今回のCBP遺伝子のように活性を失わせるタイプが存在する。活性化する場合は、その遺伝子を標的に機能を阻害する治療を行うが、不活性化する場合はその遺伝子自体を標的にすることができない。しかし、不活性化した遺伝子とパートナーの関係で機能を補助する遺伝子が存在する場合があり、このパートナーの遺伝子を阻害すると細胞が致死する現象を合成致死という。合成致死は、新しいアプローチの治療方法として大きく期待されている。
p300タンパク質の機能阻害する薬剤、抗がん剤の候補に
CBP遺伝子が変異したがん細胞は正常細胞と比べて、p300タンパク質の必要性が高まっている。これは、CBPタンパク質とp300タンパク質が、細胞内でお互いに補い合いながら働いており、CBPタンパク質が異常となったがん細胞では、p300タンパク質の機能が生存に必要なためであると考えられる。今回の結果ではCBPタンパク質とp300タンパク質の両方がなくなると、細胞の生存に必要なMYCタンパク質の発現がなくなってしまうことが細胞死の原因であると突き止めた。
CBPタンパク質とp300タンパク質は、染色体を構成するヒストンタンパク質をアセチル化する酵素であり、アセチル化は、がん細胞を含めたすべての細胞が生きていくために必要な反応である。そこで、p300タンパク質の機能を阻害する薬剤を用いることで、CBP変異がん細胞を効率よく細胞死に導くことができると考えられる。つまり、p300タンパク質の機能を阻害する薬剤が、抗がん剤の候補になるという。
国がんは、同分野ではこれまで、肺腺がんに対して別の染色体制御遺伝子であるBRG1/SMARCA4について、合成致死に基づく治療法を見出し、抗がん剤の開発進めてきた。今回の研究成果により、CBP遺伝子変異を認めるがんに対して、p300遺伝子を標的に機能を阻害することで特異的にがん細胞を殺傷する治療手法が見出され、今後、新しい抗がん剤創出に向け研究開発が進められるとしている。
▼関連リンク
・国立がん研究センター プレスリリース




