多剤耐性菌に対する抗菌薬の新たな作用点としてMurDに着目
北海道大学は11月20日、同大学先端生命科学研究院稲垣冬彦特任教授、理学研究院の齋尾智英助教らの研究グループが、細菌の細胞壁合成に関わるタンパク質酵素であるMurD(ムルディ)の立体構造をモニターし、その変化を詳細に観察することに成功したと発表した。
画像はリリースより
現在、多剤耐性菌など抗生物質が効かない菌が出回り、体力がない高齢者や入院患者等にとって脅威となり、新たな抗菌効果をもつ化合物の研究開発が求められている。こうしたなか、研究チームは、細菌の細胞壁合成に関わるMurDと呼ばれるタンパク質酵素に着目し、研究を進めてきた。
生体内で種々の重要な機能を果たすタンパク質は、柔軟にそのカタチ(立体構造)を変えながら機能している。MurDは複数の立体構造単位(ドメイン)から構成されるマルチドメインタンパク質で、基質の結合や酵素反応の進行によって大きくその立体構造を変化させながら機能することが知られていた。しかし、そのような変化を詳細に解析するための手法の欠如から、研究が進んでいなかった。
MurDの構造変化と基質結合の制御の詳細が明らかに
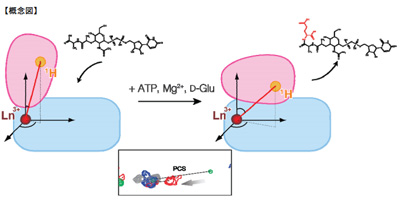
同研究グループは、溶液状態のタンパク質を観測する核磁気共鳴法(NMR法)を主体とし、MurDの立体構造変化を詳細に観察した。この研究で鍵となったのは、常磁性ランタニドイオンの活用だ。通常のNMR解析では、5Å(オングストローム)程度の範囲内に近接する原子核間からの距離情報に依存するのに対し、常磁性ランタニドイオンを組み合わせることによって、40Åという長距離間での情報を迅速に取得することができる。MurDのサイズは直径約60Å程度なので、ランタニドイオンから得られる長距離情報はMurDの全体像を得る上で特に有効になるという。
そして研究グループは、常磁性ランタニドイオンを用いたNMR法によって、基質結合に伴うMurDの立体構造変化を捉えることに成功。その結果、MurDの立体構造が開状態と閉状態の中間に位置するsemi-closed状態が存在することが初めて明らかになった。さらに、このsemi-closed状態が基質結合の順序を決定する上で重要であることが示されたという。
細菌に特異的なタンパク質であるMurDは、抗菌剤の新たな作用点としても注目を集めていたが、MurDのダイナミックな構造変化とそれに対する知見の乏しさから薬剤設計が難しいとされてきた。今回の研究によってMurDの構造変化とそれによる基質結合の制御の詳細が明らかになったことにより、薬剤設計への貢献も期待される。
▼関連リンク
・北海道大学 プレスリリース




