スパインの形態形成にタンパク質「α2キメリン」が関与
国立遺伝学研究所は10月14日、同研究所形質遺伝研究部門の岩田亮平研究員、岩里琢治教授らが、理化学研究所脳科学総合研究センターの糸原重美チームリーダーらとともに、自ら作製した複数種類のノックアウトマウスを解析し、スパインの形態形成に「α2キメリン」というタンパク質が関与していることを発見し、このタンパク質が発達期の脳ではたらくことで、大人になってからのスパインの形態と脳機能(記憶力)を調節していることを突き止めたと発表した。
画像はリリースより
記憶や学習などの脳機能は、神経細胞が無数につながった回路内で、情報がやりとりされることで発揮される。神経細胞の樹状突起にはスパインとよばれる小さな棘状の構造がある。マウスを用いた研究では、記憶が形成される際にその記憶に使われるスパインの形態(大きさと数)が増大し、逆に使わない回路のスパインは小さくなり数も減少する。さらに自閉症や統合失調症などの患者の脳の多くで、スパイン形態の異常が見つかっている。これらの知見は、スパインの形態が脳機能に重要な影響を及ぼすことを示している。
一方で、「どのような分子が、いつ、どのようにはたらくことで、スパインの形態を制御しているのか」についての知見は不足している。さらに、スパインの形態は大人になってからも柔軟に変化するために、「大人のスパインが、子どもの時のスパイン形成によって、どのように、どのくらい影響を受けるのか」といったことも謎のままだった。
脳発達の理解や自閉症などの病態解明に期待
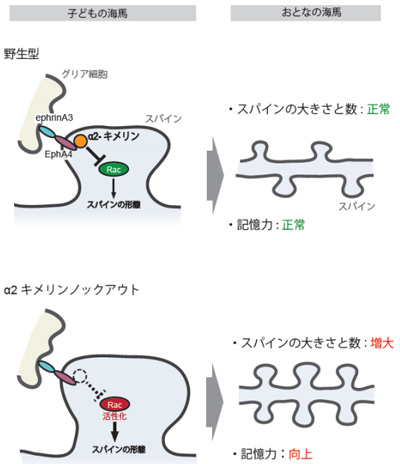
研究グループは細胞の形態制御に関与するタンパク質であるα2キメリンに着目。まず、記憶力向上の原因となる海馬の神経回路異常を細胞形態レベルで探る目的で、α2キメリンノックアウトマウスを作り、その海馬を解析。すると、スパインが大きくなり、数も増えていることが判明した。加えて、スパインの大きさと数の抑制が、ephrinA3-EphA4というシグナルを介したα2キメリンの活性化によって起きていることも突き止めた。一方、記憶力が正常なα1キメリンのノックアウトマウスでは、スパインの異常は見られなかったという。
また、大人になってから海馬のα2キメリンをノックアウトしたところ、このマウスではスパイン形態の異常がみられないことが判明。一方、胎児期にα2キメリンをノックアウトしたマウスでは、大人になってからのスパインが大きく、数も増えていた。子どもの時期(スパイン形成が活発になる前の生後10日目頃)にノックアウトしたマウスでも同様だったという。
以上のことから、研究グループは、α2キメリンがスパインの大きさや数を抑制すること、α2キメリンは大人ではなく子どもの海馬ではたらくことによって「大人になってからの海馬のスパイン形態と、海馬を用いる記憶能力」を適度に保つはたらきを担うと結論付けた。これらの研究成果は、脳発達の理解や、自閉症などの病態解明にも役立つと期待される。
▼関連リンク
・国立遺伝学研究所 プレスリリース




