肝細胞が血中乳酸値を低下させるメカニズムを解明
慶應義塾大学は9月9日、乳酸アシドーシスにつながる血中乳酸値の上昇に対して、酸素濃度センサー分子であるプロリン水酸化酵素PHD2を不活性化させることによって、肝細胞がより多くの乳酸を血中から取り込むことで血中乳酸値を低下させるメカニズムを解明したと発表した。
画像はリリースより
この研究成果は、同医学部の南嶋洋司特任講師、壽原朋宏医師(大学院医学研究科博士課程)、菱木貴子専任講師、笠原正貴東京歯科大学教授ら研究グループによるもの。米科学雑誌「米国科学アカデミー紀要(PNAS)」オンライン速報版に8月31日付で公開されている。
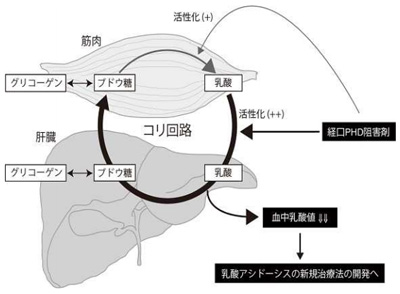
細胞のエネルギー代謝が、酸素を使わずにブドウ糖からエネルギーを産生する嫌気解糖に切り替わった結果として筋肉などから血中に放出された乳酸は、血液の流れに乗って肝臓に運ばれ、肝細胞においてブドウ糖に変換(糖新生)。再び血液の流れに乗って筋肉などに戻され嫌気解糖に利用され、そこでまた乳酸が産生されるというリサイクル回路(コリ回路)によって制御されていることは古くから知られている。
研究グループは、酸素濃度センサーであるPHD2遺伝子を肝臓でのみ破壊することによって、肝臓においてのみ低酸素応答を活性化したマウスを作製。肝臓における低酸素応答が全身の乳酸の代謝に与える影響を観察した。その結果、同マウスにおいては、1時間ほどベルトコンベアの上を走らせることで運動負荷を加えて高乳酸血症を誘導しても、野生型マウスと比較して血中乳酸値は有意に低値であり、また野生型マウスよりも長時間走ることができることを確認したという。
敗血症などの病態に対する新たな治療法の開発につながるか
さらに、PHD2を肝臓でのみ破壊したマウスでは、致死量の乳酸を腹腔内に投与しても、野生型マウスと比較して血中乳酸値は有意に低値で、血液は酸性(アシドーシス)には傾かずに中性を維持しており、マウスの生存率も劇的に改善することを明らかにしたという。
心不全、敗血症などの重篤なショック状態により血中乳酸値が上昇することで引き起こされる乳酸アシドーシスは、致死率が約50%と高く、早急な対応が求められる。研究グループは、致死量の大腸菌毒素を投与して作製した敗血症モデルマウスに、PHD2の阻害剤を経口投与。その結果、PHD2阻害剤を経口投与したマウス群においては、野生型マウスと比較して血中乳酸値の上昇が認められず、かつマウスの生存率の著明な改善を確認したという。
従来、細胞の酸素濃度センサーであるPHD2が不活性化すると、低酸素応答(利用できる酸素が少なくなった時に細胞が見せる応答反応)が活性化して、大量の乳酸が細胞から血中に放出されるとされていたが、今回の研究によって、「肝細胞における低酸素応答は、乳酸の放出を亢進させるのではなく逆に乳酸の取り込みを活性化させる」という、従来の認識を覆す新たな事実を証明したことになる。
同研究成果は、肝臓におけるPHD2を介した低酸素応答を標的とする全く新しい乳酸アシドーシスの治療法の開発、ひいては重症感染症などの治療成績改善へとつながるものと期待される。
▼関連リンク
・慶應義塾大学 プレスリリース




